Info AAMA
Boletín AAMA
Boletín AAMA
REFLEXIONES SOBRE LA PANDEMIA DE SARS- CoV-2 Y EL IMPACTO EN LAS DIFERENTES ÁREAS DE LA SALUD.
La epidemia iniciada en Wuhan en diciembre de 2019 causada por el SARS-CoV-2, alcanza el grado de pandemia declarado por la WHO en marzo de 2020. Esta rápida expansión que compromete a gran parte del planeta, con más de 21 millones de infectados y más de 700 000 muertes., ha movilizado a todos los profesionales de la Salud; no solamente en el campo de batalla, sino a quienes integran comisiones y grupos de trabajo de las sociedades científicas nacionales e internacionales. Desde marzo del 2020 hasta la fecha se han publicado centenares de trabajos científicos, muchos de ellos de relevancia, así como también guías y recomendaciones de las distintas Sociedades. La Dirección de Publicaciones de AAMA, en un intento de aportar información científica de relevancia y en sintonía con los tiempos de pandemia, publica por primera vez este Boletín dedicado al COVID-19, que esperamos sea de interés para todos los colegas.
Reflections and recommendations on the COVID-19 pandemic: Should hormone therapy be discontinued?
TRADUCIDO AL ESPAÑOL
Reflexiones y recomendaciones en la pandemia por COVID-19:
¿Deberíamos discontinuar la terapia hormonal?
El surgimiento de la pandemia, con altas tasas de morbilidad y mortalidad son motivo de
preocupación a todas las autoridades sanitarias del mundo. La muerte por COVID-19 debido al
síndrome de distrés respiratorio agudo y la falla multiorgánica y coronaria también puede contribuir.
Se destacan los mecanismos de alteración endotelial, tormenta de citoquinas, inflamación,
exudación en pulmón y oclusiones vasculares.
Diferencia entre sexos
La mortalidad por COVID-19 es más alta en hombres que en mujeres. Esto se debe a los
diferentes factores de riesgo como tabaquismo, menor cuidado de la salud y a diferentes
asociaciones con otras morbilidades. Sin embargo, una diferencia en la expresión de la ECA II podría
explicar la diferencia en la mortalidad entre sexos.
La progresión de la enfermedad por COVID-19 está reducida por la expresión endotelial de la
enzima ECA II en el pulmón y el corazón, donde provoca efectos vasodilatadores, anticoagulantes y
antiinflamatorios. ACE II se encuentra codificada por el cromosoma X y su expresión en las células
del endotelio es estimulada por los estrógenos.
A favor de este argumento, la evidencia indica que la mortalidad reducida en mujeres fértiles
en comparación con los hombres se pierde en parte en mujeres postmenopáusicas.
Terapia Hormonal
Se especula que la terapia hormonal podría antagonizar la progresión de la mortalidad de
esta enfermedad. Por otro lado, los estrógenos exógenos pueden aumentar los factores de
coagulación y los riesgos de eventos tromboembólicos con un potencial aumento en la mortalidad.
En individuos hospitalizados con enfermedad COVID-19 severa, se observa un estado coagulante
activo que se define con altos valores de Dímero D, productos de degradación del fibrinógeno y
cuando el Dímero D se encuentra muy aumentados, la administración de anticoagulantes como la
heparina, pueden reducir la mortalidad. Para reducir el riesgo de los eventos trombóticos, una
reciente publicación recomendó que las mujeres peri y posmenopáusicas abandonen la
administración exógena de hormonas cuando se infectan por COVID-19. Esto lleva a lo siguiente:
1. Los estados trombofílicos no se encuentran dentro de las comorbilidades que
aceleran la progresión de COVID-19. A la fecha, no hay reportes que documentan
que los estados más trombogénicos en la vida de la mujer: embarazo o
anticoncepción hormonal estén asociados con peor pronóstico de infección por
COVID-19.
2. La trombosis local tiene mayores consecuencias masivas a nivel endotelial y en la
activación de la cascada de la coagulación en comparación con el embolismo en los
últimos estadios de la enfermedad. Es más, la evidencia que muchas mujeres con
oclusión vascular pulmonar carecen de trombosis venosa periférica, desafía la teoría
de un gran aumento de la condición trombogénica.
3. El aumento del riesgo de trombosis venosa debido al incremento de la síntesis de los
factores de coagulación está limitado a los primeros dos años de administración de
estrógenos orales. Hasta el momento, no hay estudios reportados sobre el efecto
trombogénico de los estrógenos transdérmicos.
4. Las mujeres peri menopáusicas que requieren anticoncepción hormonal
habitualmente se encuentran a finales de sus 40 años y la mujer pos menopaúsica
que comienza su terapia hormonal lo hace antes de los 60 años. En estas edades, la
mortalidad por COVID-19 es menor al 1% y no hay casos reportados que sea mayor
en mujeres bajo tratamiento hormonal.
Conclusiones
En principio, las indicaciones para pacientes COVID-19 para discontinuar la terapia hormonal
o la anticoncepción oral parecerían ser una sabia recomendación, pero no está basado en datos
reales. Se está teniendo en consideración un solo lado de la moneda, la actividad de los estrógenos
exógenos procoagulante. Este efecto en pacientes COVID-10 es aparentemente el menos
importante. En estos individuos, el incremento de la coagulación es consecuencia de la disrupción
endotelial masiva y de la activación de la cascada extrínseca de la coagulación, sin evidencia que
exista un aumento del rol de los factores de coagulación. En contraposición, la sugerencia de dejar
los estrógenos dejaría de lado su principal efecto en la estimulación de la expresión de la enzima ECA
II, un factor crítico en la disminución de la mortalidad de COVID-19.
Recomendaciones
Se sugiere que el consejo para mujeres infectadas con COVID-19 debería ser:
a. La terapia hormonal o la contracepción hormonales deberían continuarse a menos
que la mujer se encuentre severamente enferma, una condición en donde el balance
hormonal podría no ser crucial. En otras condiciones, la posibilidad de que el abandono del
tratamiento hormonal podría acelerar la progresión COVID-19 no debería ser excluida y el
abandono del tratamiento debería ser evitado.
b. En caso de que la enfermedad progrese de una simple gripe a síntomas más severos,
sería adecuado el respaldarse en especialistas que consideren la adición del uso de heparina
usada como anticoagulante, antiinflamatorio y inmuno-modulador.
c. Cambiar de estrógenos orales a transdérmicos (gel y parche) podría ser considerado,
pero no es mandatorio.
d. Para comenzar o recomenzar la terapia hormonal, sería útil utilizar la vía
transdérmica en vez de estrógenos orales.
En el caso de que la terapia hormonal se discontinúe, se debería recordar que podrían ocurrir
sangrados.
Documento elaborado en conjunto por la Asociación Española para el Estudio de la Menopausia (AEEM), Sociedad Española de Ginecología y Obstetricia (SEGO) y Sociedad Española de Trombosis y Hemostasia (SETH).
Assessment of SARS-CoV-2 in human semen—a cohort study.
TRADUCIDO AL ESPAÑOL
Evaluacion de SARS-CoV-2 en semen humano – un estudio de cohorte.
Objetivo: Investigar la presencia de ARN viral en el semen humano de
pacientes con síndrome respiratorio agudo severo por corona-
virus 2 (SARS-CoV-2) y evaluar su presencia y relevancia en los parametros
seminales.
DISEÑO: Estudio piloto de cohorte.
Paciente(s): Treinta y cuatro hombres fueron distribuidos en:
1) pacientes en convalecencia (pacientes con infeccion por SARS-CoV-2
confirmada en hisopado faríngeo segun reaccion en cadena de la polimerasa
de transcripcion reversa [RT-PCR] o anticuerpos);
2) grupo control negativo (sin anticuerpos); y 3) pacientes con infeccion aguda
(detecci on de SARS-CoV-2 en hisopado faríngeo).
INTERVENCIÓN :
Se obtuvieron muestras de semen y sangre de cada individuo.
Medida(s) de Resultado Principal: El analisis de la calidad seminal de acuerdo a
los parametros de la Organizacion Mundial de la Salud. La deteccion de SARS-
CoV-2 por RT-PCR en muestra de semen en fresco y despues de la preparacion
por gradiente de densidad.
La confirmacion de anticuerpos de inmunoglobulina (Ig) A e IgG en sangre.
RESULTADOS:
Se obtuvieron dieciocho muestras de semen de hombres recuperados entre
los 8-54 días despues de la ausencia de
síntomas, 14 de sujetos control, y 2 de pacientes con una infeccion activa por
COVID-19. No se detect o ARN por RT-PCR en el semen,
incluyendo las muestras de semen de los dos pacientes con infeccion aguda
por COVID-19. Los sujetos con una infecci on moderada
mostraron deterioro de la calidad seminal.
CONCLUSIONES
No es probable que una infeccion leve por COVID-19 afecte la funcion
testicular y epididimaria, mientras que los parametros seminales parecieron
deteriorarse despues de una infeccion moderada. El ARN de SARS-CoV-2 no
pudo ser detectado en el semen de hombres COVID-19 positivos ya
recuperados y con infeccion aguda. Esto sugiere que no hay transmisi on viral
durante el contacto sexual y las tecnicas de reproduccion asistida, aunque se necesita
obtener mas informacion.
Pandemics: learning from the past.
Guías Españolas sobre Embarazo, RN y COVID 19.
COVID 19 y Reproducción Humana.
Coronavirus Disease 2019 (COVID-19) Treatment Guidelines
|
|
|
|
|
|
|
|
|
VITAMIN D AND BONE MINERAL DENSITY IN ARGENTINIAN PATIENTS WITH MULTIPLE SCLEROSIS: PRELIMINAR RESULTS OF A PILOT STUDY M.R. Ulla1, C. Vrech2, E. Peralta López3, M.J. Castro1, F. Martos1, M.A. Rivoira3 1 Fundación ILAIM, Córdoba, Argentina. Especialista en Medicina Interna y Endocrinología. Magister en Investigación Clínica Farmacológica. Directora del Instituto Latinoamericano de Investigaciones Medicas -ILAIM Investigadora Principal de Múltiples Estudios Clínicos en Fase 2 y 3 Randomizados en Patologías a relacionadas a Síndrome Metabólico, Diabetes, Endocrinopatias, Metabolismo Fosfocalcico , Menopausia entre otros. 2 Sanatorio Allende, Córdoba, Argentina 3 Facultad de Ciencias Médicas, UNC, Córdoba, Argentina. CONTACT INFORMATION: ullamariarosa@gmail.com, mariaangelicarivoira@yahoo.com.ar INTRODUCTION Multiple sclerosis (MS) is a chronic, inflammatory, autoimmune, demyelinating disease of the nervous system. Currently, relapsing-remitting multiple sclerosis (RRMS) is the most common type of the disease. These patients are frequently exposed to high doses of corticosteroids, thus having risk for secondary osteoporosis, frequently aggravated by restriction of mobility due to physical deficit, which can predispose to fractures and cause further deterioration in the quality of life. Recent statistics from Argentina have shown an increasing prevalence of 32 patients in every 100,000 inhabitants. AIM Since there is no similar study in local literature so far, we aimed at assessing bone health and vitamin D levels in these patients MATERIALS AND METHODS – Observational, prospective, open case-control study evaluating serum levels of 25(OH)vitamin D as well as bone mineral density (BMD) in femoral neck, total hip and lumbar spine, in self-reliant patients with RRMS, compared to healthy controls – Thirty-six patients with RRMS (8 men and 28 women) between 20 and 59 years of age and 36 healthy patients of similar age and sex were included. All the women were pre-menopausal – The patients had an Expanded Disability Status Scale less than 5.0 and all had received a corticosteroid pulse the year prior to bone densitometry. A survey of physical activity and dairy consumption was carried out RESULTS
|
Asociación entre masa corporal magra y síntomas menopáusicos : Estudio SWAN
Association of lean body mass to menopausal symptoms: The Study of Women’s Health Across the Nation Rosanne Woods* , Rebecca Hess, Carol Biddington and Marc Federico
El objetivo de este trabajo fue examinar la asociación entre masa corporal magra y el desarrollo de síntomas vasomotores (SVM) en mujeres en la transición a la menopausia.
Este estudio post hoc, se realizó con los datos disponibles y de uso público del estudio SWAN a partir del seguimiento anual, realizado en 2533 mujeres con edades comprendidas entre 42-52 años, en un periodo de 10 años.
Los datos recolectados, masa corporal magra (MCM) y SVM, fueron cruzados entre sí.
Los cambios de masa magra fueron obtenidos antes del inicio del estudio y al inicio de éste, mediante una regresión binaria ajustada por covariables.
Transversalmente, la presencia de algún SVM ( sofocos o sudoración nocturna) se asoció negativamente con la MCM basal ( OR 0.93; 95% IC, 0.87–0.99; p = 0.036).
En el análisis longitudinal, los SVM se asociaron negativamente, con los porcentajes de cambio en MCM entre la medición basal (0.12 [0.04–0.33], p < 0.001) y la primera visita (0.17 [0.06–0.49], p < 0.003)
La probabilidad estimada de desarrollar SVM disminuyó en forma significativa cuando aumentaba la MCM ( de 71% en mujeres con índice de masa muscular esquelética (IMME) de 4 a 37% en aquella con IME de 14)
Estos resultados sugieren que manteniendo la masa muscular, a través de un entrenamiento con resistencia, se puede proteger a las mujeres de padecer SVM en la transición a la menopausia.
El IMME se puede medir mediante bioimpedancia eléctrica y permite el diagnóstico de sarcopenia. Esta se la define como la pérdida de fuerza de la masa muscular, vinculada a la edad. Se asocia con discapacidad funcional con limitaciones en la movilidad como caminar o subir escaleras, lo que ocasiona desmejoramiento de la calidad de vida. Esta prevalencia aumentó del 37 % en mujeres en los 40 ́s a 57% en los 50 ´s, sugiriendo una relación entre edad y la patogénesis de esta enfermedad.
En este novedoso trabajo, el hallazgo en la mejoría de los síntomas vasomotores en mujeres jóvenes sometidas a entrenamiento físico, nos ofrece una opción interesante para el manejo de los sofocos.
Referencias
Woods R, Hess R, Biddington C, Federico M. Association of lean body mass to menopausal symptoms: The Study of Women’s Health Across the Nation. Womens Midlife Health, 2020, 6:10. https://pubmed.ncbi.nlm.nih.gov/32944260/
Carina O. Walowski , Wiebke Braun , Michael J. Maisch , Björn Jensen , Sven Peine , Kristina Norman , Manfred J. Müller and Anja Bosy-Westphal. Reference Values for Skeletal Muscle Mass – Current Concepts and Methodological Considerations
Nutrients 2020, 12, 755; doi:10.3390/nu12030755
http://www.mdpi.com/journal/nutrients
Jeong Jae Moon, Sam-Guk Park, Seung Min Ryu, Chan-Ho Park
New Skeletal Muscle Mass Index in Diagnosis of Sarcopenia
J Bone Metab 2018;25:15-21 http://dx.doi.org/10.11005/jbm.2018.25.1.15
Berin E, Hammar M, Lindblom H, Lindh-Åstrand L, Rubér M, Spetz Holm AC: Resistance training for hot flushes in postmenopausal women: A randomised controlled trial. Maturitas 2019, 126:55-60. https://pubmed.ncbi.nlm.nih.gov/31239119/
Zhou Y, Zheng Y, Li C, Hu J, Zhou Y, Geng L, Tao M. Association of body composition with menopausal symptoms in (peri-)menopausal women. Climacteric 2018, 21(2):179-183 https://pubmed.ncbi.nlm.nih.gov/29390893/
Manejo de los síntomas vasomotores en mujeres adultas mayores
Managing menopausal vasomotor symptoms in older women
Cynthia A. Stuenkel *
Department of Medicine, Division of Endocrinology and Metabolism, University of California, San Diego, School of Medicine La Jolla, CA, USA
El objetivo de este review es exponer un tema de suma interés, como es la persistencia de síntomas vasomotores (SVM) en mujeres adultas mayores.
Si bien estos síntomas son más prevalentes en mujeres jóvenes, durante la transición a la menopausia y los primeros años, los estudios clínicos longitudinales y nuestra propia experiencia, confirman que los SVM son frecuentes después de los 60 años. El estudio Penn Ovarian Aging, muestra que ⅓ de las mujeres persiste con SVM después de 10 años de menopausia.
El SWAN, reporta que ¼ de las mujeres tienen sofocos, 9.4 años después de la menopausia.
En el Women ‘s Health Initiative (WHI), 4,8% de las mujeres mayores de 70 años en el brazo de terapia combinada y 8,7% del brazo de sólo estrógenos, reportaron SVM moderados a intensos al inicio del estudio.
Está protocolarmente aceptado que la THM está dirigida a mujeres jóvenes sanas y hasta con 10 años de transcurrida la última menstruación. Aprendimos que la THM en las adultas mayores, aumenta el riesgo de eventos cardiovasculares y demencia.
Estudios recientes relacionan la fisiología de los sofocos con el daño endotelial y la evidencia del aumento de ECV subclínica y de eventos CV.
Investigaciones clínicas, han demostrado que las adultas mayores con sofocos persistentes, tienen un riesgo aumentado de ECV, en respuesta a THM oral comparado con mujeres asintomáticas de la misma edad.
Las Guías de Práctica Clínica de la Endocrine Society, compara la eficacia relativa de prescripciones farmacológicas no hormonales y subraya la importancia del placebo en los protocolos de SVM.
Los investigadores de MsFlash, condujeron un análisis con un pool de 6 estudios de intervención y reportaron la misma disminución de los SVM moderados con 17-B estradiol (oral) 0.5 mg/d, escitalopram 10− 20 mg/d, y venlafaxine 75 mg SR/d; el ejercicio y el omega-3 fatty acids no fueron efectivos.
Un algoritmo terapéutico, propone 4 semanas con una medicación única, que puede ir cambiando progresivamente con: escitalopram o citalopram,
venlafaxine, paroxetine, gabapentin, oxybutynin y finalmente con clonidina.
existen protocolos en desarrollo con nuevos agentes: oxybutynin, antagonista del receptor neurokinin-3 y phytoSERM (genistein, daidzein y S-equol).
El aumento de la expectativa de vida de la población de mujeres mayores, representa un desafío para el diseño de estrategias de tratamiento que promuevan la salud y el mantenimiento de calidad de vida.
Referencias
C.A. Stuenkel C. Managing menopausal vasomotor symptoms in older women
Maturitas 143(2021) 36-40.
https://doi.org/10.1016/j.maturitas.2020.08.005
C.A. Stuenkel, S.R. Davis, A. Gompel, M.A. Lumsden, M.H. Murad, J.V. Pinkerton, J.R. Santen, Treatment of symptoms of menopause: an endocrine society clinical practice guideline, J. Clin. Endocrinol. Metab. 100 (2015) 3975–4011. Epub 2015 Oct 7.
T.J. De Villiers, J.E. Hall, J.V. Pinkerton, et al., Revised global consensus statement on menopausal hormone therapy, Maturitas 91 (2016) 153–155.
The NAMS 2017 Hormone Therapy Position Statement Advisory Panel, The 2017 hormone therapy position statement of the North American menopause society, Menopause 24 (2017) 728–753.
R.C. Thurston, Vasomotor symptoms: natural history, physiology, and links with cardiovascular health, Climacteric 21 (2018) 96–100.
V.M. Miller, J.M. Kling, J.A. Files, M.J. Joyner, E. Kapoor, A.M. Moyer, W.A. Rocca, S.S. Faubion, What’s in a name: are menopausal “hot flashes” a symptom of menopause or a manifestation of neurovascular dysregulation? Menopause 25 (2018) 700–703.
N. Biglia, A. Cagnacci, M. Gambacciani, S. Lello, S. Maffei, R.E. Nappi, Vasomotor symptoms in menopause: a biomarker of cardiovascular disease risk and other chronic diseases? Climacteric 20 (2017) 306–312.
Comparing an adiposopathy approach with four popular classifications schemes to categorize the metabolic profile of postmenopausal women.
Comparación de cuatro clasificaciones de adiposopatias para categorizar perfil metabólico en mujeres postmenopáusicas.
Journal of Physiology and Biochemistry.
https://doi.org/10.1007/s13105-020-00766-w. Mauriège et al. Published on line 24 september 2020.
Existen distintas variantes de obesidad. Los individuos obesos metabólicamente
sanos, con perfiles metabólicos normales y los obesos con un status metabólico alterado.
Se han utilizado numerosas clasificaciones para distinguir la denominada obesidad
metabólicamente sana (MHO) de la obesidad metabólicamente anormal (MAO).
Si bien no hay consenso en la definición del fenotipo MHO, hay hasta la fecha al
menos 15 métodos para identificar a estos individuos. Además, dependiendo de la
definición, la prevalencia del fenotipo MHO puede ser del 3 al 57% de los adultos, de los
cuales 25-30% son mujeres postmenopáusicas.
El objetivo de este estudio fue comparar un fenotipo único y la adiposopatía (relación
adiponectina/leptina plasmática), con cuatro clasificaciones de uso común empleados por la
Federación Internacional de Diabetes (FID), Karelis, Lynch, Wildman; las cuales están
basadas en la obesidad junto a otros factores de riesgo, con la posibilidad de discriminar
diferencias fenotípicas entre MAO y MHO, en mujeres posmenopáusicas.
Todavía se desconocen los mecanismos que explican las diferencias en los perfiles
metabólicos de los individuos MAO y MHO. Algunos trabajos sugieren que el nivel alto de
adiponectina en el ayuno estaría potencialmente involucrado en la fisiología del fenotipo
MHO.
Recientemente en la revisión de Frühbeck et al se encontró que la relación
adiponectina / leptina predice mejor el riesgo cardiometabólico y particularmente la IR
(insulinorresistencia) que el valor aislado de adiponectina o leptina.
En el presente trabajo participaron 79 mujeres postmenopáusicas, obesas,
sedentarias y no diabéticas (60 ± 5 años; BMI, 34.0 ± 3.7 kg/m2)
Se recogieron datos antropométricos, peso corporal total, porcentaje de grasa corporal,
porcentaje de masa grasa, presión arterial, Fitness cardiorespiratorio, lipoproteínas,
enzimas hepáticas, adipokinas inflamatorias y un TTOG. Se estudiaron en 48 mujeres las
concentraciones plasmáticas de TNF-α e IL-6 y sus respectivos receptores solubles, así
como adiponectina y leptina. La relación adiponectina / leptina se utilizó como índice de
adiposopatía. Una relación alta se identificó con MHO y una relación baja con MAO.
Se realizó el análisis de 1g de tejido adiposo subcutáneo abdominal (SCAT) a través
de una mini liposucción, donde se estudiaron genes ligados al metabolismo de ácidos
grasos e inflamatorios en 48 pacientes. Del mismo se seleccionaron genes que pudieran
representar diferencias entre las mujeres MAO y MHO.
Los resultados se presentaron en tablas como medias de desviación estándar (DE).
Se utilizó la prueba de Welch para determinar diferencias entre mujeres MAO y MHO.
Se observó que el estudio de la adiposopatía proporcionó mejores herramientas
para la diferenciación de MAO y MHO que las cuatro clasificaciones de uso común.
Uno de los fuertes del presente trabajo fue la utilización de la composición corporal y
el estudio de la sensibilidad a la insulina, así como también el uso de los diferentes
marcadores inflamatorios. Otro punto importante fue el estudio de los niveles de ARNm en
el SCAT abdominal, dado que proporciona información sobre los genes involucrados en el
almacenamiento y movilización de lípidos.
Los resultados obtenidos demuestran que la evaluación de la adiposopatía es casi tan
eficaz como la Clasificación de Karelis para diferenciar entre mujeres postmenopáusicas
MAO y MHO.
Factors Associated with Dietary Control and Physical Activity in the
Management of Metabolic Syndrome in Korean Menopausal Women
Guna Lee and Hye Young Choi
Factores asociados a la dieta y la actividad física en el manejo del Síndrome
Metabólico en mujeres coreanas postmenopáusicas.
Int. J. Environ. Res. Public Health 2020, 17, 6901; doi:10.3390/ijerph17186901
www.mdpi.com/journal/ijerph
La prevalencia global de Síndrome Metabólico (SM), definido como un conjunto de
signos clínicos como obesidad abdominal, triglicéridos elevados, hipertensión
arterial, glucosa en plasma elevada y reducción de HDL-C, está aumentando entre
las mujeres coreanas adultas. Se calcula que aproximadamente el 26-30% de la
población padece SM.
La severidad de esta patología aumenta en las mujeres postmenopáusicas, por ello
la necesidad de tomar medidas efectivas para el manejo y prevención de patologías
asociadas como las cardiovasculares (HTA; infarto miocardio, angor, ACV), diabetes
y cáncer ( colorrectal, mama).
El manejo terapeútico del SM, combina modificaciones en el estilo de vida e
intervenciones farmacológicas.
Entendiendo como cambios en el estilo de vida el control nutricional y la actividad
física, que aseguran un manejo exitoso del SM, mejorando parámetros clínicos
como hipertensión, glucemia en ayunas y aumento de HDL-C.
No hay datos suficientes que demuestren la adherencia a los cambios en el estilo
de vida saludables.
El objetivo del trabajo fue investigar el grado de SM y factores asociados (agrupados
por status socioeconómico, estilo de vida, control nutricional y actividad física), en
mujeres PM, en una muestra representativa de mujeres coreanas.
Este estudio se realizó sobre la base de datos obtenidos en el KNHANES (Korean
National Health and Nutrition Examination Survey). Las personas seleccionadas fueron
564 mujeres postmenopáusicas con SM, de una base de 16,277.
Los análisis de los controles nutricionales, de acuerdo a características
sociodemográficas variaban según la edad, nivel de educación, ingresos y
co-residencia.
De las mujeres con SM, 36,1% realizaban control dietario y 39,5% actividad física.
Las que mayor adherencia a una dieta estaban dentro del grupo etario de 40-49
(OR: 3.38; 95% (CI): 1.25–9.18), las que realizaban actividad física (OR: 2.24; CI:
1.43–3.52), tomaban medicación antihipertensiva (OR: 1.66; CI: 1.04–2.67) o
medicación para diabetes (OR: 2.99; CI: 1.80–4.97). Las mujeres que se
enganchaban con actividad física, también hacían controles nutricionales (OR: 2.32;
CI: 1.42–3.51).
El grupo que más se controlaba nutricionalmente tenía niveles de educación más
altos. Estos mismos datos se repiten con la actividad física (40.7% vs 29.8%)
El grupo de mujeres mayores de 60 años, mostró que no sólo no hacían dieta y
actividad física, sino que tampoco tomaban medicación para las patologías
asociadas.
En conclusión, las mujeres mayores, con bajos niveles educativos y recursos
socioeconómicos, son las que necesitan más controles sanitarios, y deben ser el
foco de atención epidemiológico.
La importancia del buen dormir
¿Qué sucede con el sueño durante el climaterio?
El sueño es una función fundamental para la realización de múltiples procesos cerebrales como el aprendizaje, consolidación de la memoria, y regulaciones metabólicas y hormonales. Las alteraciones del sueño se profundizan en el climaterio; la dificultad para iniciarlo y la mayor frecuencia de despertares nocturnos, dan como resultado un sueño de mala calidad y no reparador (1).
Definición y Epidemiología
El insomnio es la dificultad permanente de conciliar y mantener el sueño que genera un impacto negativo sobre la calidad de vida (2). Es un problema de salud muy frecuente, que genera fatiga, somnolencia, alteraciones en la atención y la memoria, y predispone a accidentes, HTA, DBT, enfermedad cardiovascular y aumento de la mortalidad (2), además de estar asociado con mayor índice de depresión y ansiedad (3).
La incidencia de insomnio aumenta con la edad, por otro lado, diferentes estudios sugieren una mayor prevalencia en mujeres, y se asocia con las fluctuaciones de las hormonas sexuales modificándose en las diferentes etapas de la vida reproductiva y el ciclo menstrual (2). La presencia de apneas obstructivas del sueño (AOS), movimientos periódicos de las piernas durante el sueño (PLMS), y los cambios en el ciclo normal del sueño (3), son algunos de los signos más frecuentemente observados.
Fisiopatología
La transición a la menopausia se asocia con alteraciones del sueño, siendo el insomnio el síntoma más referido por las mujeres menopáusicas (2). El modelo de las 3P (factores predisponentes, factores precipitantes y factores perpetuadores) se utiliza para describir el insomnio durante la transición a la menopausia (2). (ver figura 1)
Los cambios en el ciclo circadiano producen alteraciones del sueño. Estos están regulados por el núcleo supraquiasmático (hipotálamo) y por el el equilibrio homeostàtico que controla la intensidad del sueño (2). Estos sistemas son estimulados por el ciclo de luz/oscuridad y por la melatonina producida por la glándula pineal. Hoy sabemos que el proceso de envejecimiento está asociado a alteraciones del ciclo circadiano y a disminución de la secreción de melatonina, contribuyendo a la aparición de un sueño fragmentado y despertares tempranos.
El efecto de las hormonas sexuales sobre el sueño ha sido demostrado en múltiples estudios. La progesterona estimula a los receptores GABA y tiene propiedades ansiolíticas y sedantes, favoreciendo el sueño No REM; mientras que los estrógenos, parecen disminuir la latencia del sueño y el número de despertares (2). Con la caída estrogénica se ha demostrado un aumento en los despertares nocturnos.
La presencia de síntomas vasomotores (SVM), están asociados a una peor calidad de sueño, sin embargo, aún no está claro si los problemas de sueño son el resultado de la interrupción por la presencia de SVM o si son entidades separadas (1).
Tratamiento
Es importante destacar la necesidad de un enfoque multidisciplinario para lograr un buen manejo del insomnio, y de todas las alteraciones del sueño. Se debe realizar una cuidadosa evaluación tanto de los síntomas referidos y las esferas física y psicológica. En la actualidad, contamos con un amplio abanico de opciones terapéuticas tanto farmacológicas como no farmacológicas. La terapia cognitiva conductual se encuentra dentro de las primera línea de tratamiento (1, 2, 4). (Ver figura 2).
Si bien no es una indicación precisa, se vio que el uso de terapia hormonal de la menopausia (THM) en pacientes con SVM mejora la calidad del sueño al disminuir la frecuencia de los despertares nocturnos (1, 5). El tratamiento con antidepresivos ha demostrado mejorar la calidad del sueño, en mujeres con SVM (1, 2).
Finalmente, dada su buena tolerabilidad, seguridad y eficacia en múltiples parámetros del sueño y del día, la melatonina de liberación prolongada debería representar un fármaco de primera línea en mujeres mayores de 55 años, sin impacto negativo en las funciones psicomotoras, memoria y la estabilidad postural en adultos mayores (1,6).
Bibliografía
- R. Silvestri, I. Aricò, E. Bonanni, M. Bonsignore, et al (2019): Italian Association of Sleep Medicine (AIMS) position statement and guideline on the treatment of menopausal sleep disorders. Maturitas 129 (2019) 30–39. DOI: 10.1016/j.maturitas.2019.08.006
- P. Proserpio , S. Marra , C. Campana , E. C. Agostoni , L. Palagini , L. Nobili & R. E. Nappi (2020) Insomnia and menopause: a narrative review on mechanisms and treatments, Climacteric, 23:6, 539-549, DOI: 10.1080/13697137.2020.1799973
- Sheida Zolfaghari, Chun Yao, Cynthia Thompson, Nadia Gosselin, et al (2019): Effects of menopause on sleep quality and sleep disorders: Canadian Longitudinal Study on Aging. Menopause Vol. 27, No. 3, pp. 295-304. DOI: 10.1097/GME.0000000000001462
- Susan J. Diem, Andrea Z. LaCroix, Susan D. Reed, Joseph C. Larson, et al (2020): Effects of pharmacologic and nonpharmacologic interventions on menopause-related quality of life: a pooled analysis of individual participant data from four MsFLASH trials. Menopause Vol. 27, No. 10, pp. 1126-1136. DOI: 10.1097/GME.0000000000001597
- P. Tansupswatdikul, S. Chaikittisilpa, N. Jaimchariyatam, et al (2015): Effects of estrogen therapy on postmenopausal sleep quality regardless of vasomotor symptoms: A randomized trial, Climacteric 18 (2015) 198–204. DOI:10.3109/13697137.2014.964670.
- Elena Toffol, Nea Kalleinen, Sari-Leena Himanen, Timo Partonen (2021): Nighttime melatonin secretion and sleep architecture: different associations in perimenopausal and postmenopausal women. https://doi.org/10.1016/j.sleep.2021.02.011
Metformin use is associated with a lower risk of osteoporosis in adult women independent of type 2 diabetes mellitus and obesity. REDLINC IX study.
El uso de metformina se asocia con bajo riesgo de osteoporosis en mujeres adultas, independientemente de diabetes tipo 2 y obesidad. Estudio REDLINC IX.
JEBlümel, E Arteaga, S Aedo, J Arriola-Montenegro,M López, M Martino, C Miranda, O Miranda, D Mostajo, M Ñañez, E Ojeda, S Pilnik, JRojas, C Salinas, L Sosa, P. Spritzer, K Tserotas, M S. Vallejo, A Belardo, T Fighera & P.Chedraui
Gynecological Endocrinology, DOI: 10.1080/09513590.2020.1718092
To link this article:https://doi.org/10.1080/09513590.2020.1718092
Esta publicación es la novena del grupo REDLINC IX (Grupo Colaborativo para la investigación del Climaterio en Latino América). Es un estudio observacional, retrospectivo, que se realizó en 15 centros de salud de los siguientes países: Argentina, Ecuador, Paraguay, Chile, Perú, Bolivia, México, Brasil y Panamá.
Se entrevistaron 1370 mujeres, entre 40 y 89 años, que concurren a los controles ginecológicos anuales y que poseían al menos una densitometría. Los datos que se recabaron fueron : presencia de DBT2, uso de metformina, THM, tabaquismo, edad de menopausia, BMI y escolaridad. Se excluyeron de la muestra las mujeres que estuvieron en tratamiento con drogas para la osteoporosis.
Finalmente, entraron en el trabajo 1259 mujeres, con una edad promedio 61.5 años y un BMI 27.7kg/m2. La edad media de la menopausia fue 49 años.
De acuerdo a los valores de la DMO , se encontró que el 22.6% de las mujeres tenía osteoporosis; el 84.6% en columna, 37.9% en cadera y 22.4% en ambos sitios. El promedio de edad de estas mujeres era mayor que la media.
A la inversa, en la población de mujeres con valores elevados de BMI no se halló osteoporosis.
Aproximadamente el 30.2% de las participantes eran diabéticas tipo 2 y el 40.3% reportó el uso de metformina en el último año. (507 diabéticas y 380 obesas)
Las usuarias actuales de THM, calcio y vitamina D eran respectivamente 10.7%, 47.7% y 43.1%.
Se encontró una alta correlación entre uso de metformina, edad y BMI, cuando se entrecruzan los datos.
El uso de metformina, independientemente de la presencia de DBT2 y obesidad, representó un efecto protector sobre el hueso.
Este efecto positivo, observado en mujeres diabéticas, nos hace pensar en los beneficios de esta droga en la reducción de fracturas.
La fortaleza de este estudio es el análisis estadístico serio y el número de pacientes incluidos, pero la metodología empleada, no permite sacar conclusiones que podamos atribuir el efecto de la metformina en la senescencia celular, ya que no se estudiaron estos desórdenes en el tejido óseo.
Comentarios
Tanto en la diabetes tipo 1 como en la tipo 2 se observa fragilidad esquelética con el consecuente aumento del riesgo de fractura; sin embargo en la DBT2 la DMO puede ser normal o incluso elevada. Un mayor IMC se considera un factor protector contra el riesgo de fracturas. La alteración en el metabolismo de la glucosa y la insulina produce efectos directos e indirectos sobre la calidad ósea. La hiperglucemia induce la producción de especies reactivas de oxígeno (ROS) y la acumulación de AGE. Estos productos pueden causar estrés oxidativo que conduce a una homeostasis ósea anormal, dado que producen inhibición de los osteoblastos y estimulación de los osteoclastos, como así también promueven la reticulación del colágeno.(1, 2)
La senescencia celular es una condición asociada a la vejez. Las células se encuentran en un estado de detención irreversible del crecimiento, con cambios en la cromatina y secreción de moléculas bioactivas (SASP) que causan inflamación crónica y daño tisular.
La eliminación de estas células o la neutralización de las SASP podría retrasar la evolución de diferentes patologías.
Existe la hipótesis de que la metformina sería una droga capaz de modificar la senescencia del tejido óseo, de esta forma disminuiría el riesgo de osteoporosis.(3)
El mecanismo de acción de la metformina es bloquear la cadena respiratoria mitocondrial (complejo I) produciendo una inhibición de la fosforilación oxidativa y un aumento de la relación AMP /ATP. Este aumento de la relación lleva a la activación de AMPk y la activación de otras enzimas reguladas por AMPk.(4) El AMPk raciona la energía en las células y para este propósito inhibe la síntesis de proteínas y el crecimiento celular, lo realiza a través del down regulation del mTOR, el cual por ejemplo se encuentra hiperactivo en la gran mayoría de las células tumorales. (fig 1)
Un estudio realizado recientemente afirma que la AMPk puede estimular la osteogénesis en las células MC3T3-E1 e inhibir la adipogénesis en las células 3T3-L1 por la vía del AMPKGfi1-OPN.(5) Los adipocitos y los osteoblastos tienen progenitores celulares en común denominados células estromales mesenquimales (MSC) o células del estroma de la médula ósea (BMSC). La regulación de Runx2 y una vía recientemente descubierta, Wnt / b-catenina, por AMPk puede diferenciar las MSC en
osteoblastos (osteoblastogénesis), mientras que la expresión de PPARγ-2 suprime la diferenciación de osteoblastos y hace que las MSC se diferencien en
adipocitos. La isoforma PPARγ-1 puede establecer la osteoclastogénesis y la resorción ósea activando el RANKL y la señalización de c-FOS.(6, 7, 8) (fig 2). El AMPk podría suprimir la formación de osteoclastos inducida por RANKL. (9)
La metformina disminuye en células hematopoyéticas el desarrollo de los osteoclastos y previene la respuesta proinflamatoria de los macrófagos al disminuir la señalización RAGE (receptor de productos finales de glicosilación), lo cual potencialmente disminuye la reabsorción de la médula ósea y los efectos pro ateroscleróticos sobre la vasculatura ósea. (10, 11)
En síntesis, existe una relación estrecha entre diabetes y fisiología del hueso, un link entre AMPK como la molécula clave en el mecanismo de acción de metformina y los caminos que comprometen el turnover óseo. El uso de metformina, el antidiabético oral más empleado mundialmente, induce la disminución del riesgo de fractura, como está ampliamente publicado en numerosos estudios clínicos.
Bibliografia
1- Advanced glycation end products inhibit the osteogenic differentiation potential of adipose-derived stem cells by modulating Wnt/β-catenin signalling pathway via DNA methylation. Li Y, Wang L, Zhang M, et al. Cell Prolif. 2020;53:12834.
2- An overview on stem cells in tissue regeneration. Seetharaman R, Mahmood A, Kshatriya P, Patel D, Srivastava A. Curr Pharm Des. 2019;25:2086–2098.
3- Barzilai N, Crandall JP, Kritchevsky SB, Espeland MA. Metformin as a Tool to Target Aging. Cell Metab. 2016 Jun 14;23(6):1060-1065. doi: 10.1016/j.cmet.2016.05.011.
4- V. Shafiei-Irannejad, N. Samadi, R. Salehi, B. Yousefi, N. Zarghami, New insights into antidiabetic drugs: Possible applications in cancer treatment, Chem. Biol. Drug. Des. 90 (6) (2017) 1056–1066.
5- Y.-g. Wang, X.-h. Qu, Y. Yang, X.-g. Han, L. Wang, H. Qiao, Q.-m. Fan, T.-t. Tang, K.-r. Dai, AMPK promotes osteogenesis and inhibits adipogenesis through AMPKGfi1-OPN axis, Cell. Signal. 28 (9) (2016) 1270–1282.
6- J. Jeyabalan, M. Shah, B. Viollet, C. Chenu, AMP-activated protein kinase pathway and bone metabolism, J. Endocr. 212 (3) (2012) 277–290.
7- I. Takada, M. Suzawa, K. Matsumoto, S. Kato, Suppression of PPAR Transactivation Switches Cell Fate of Bone Marrow Stem Cells from Adipocytes into Osteoblasts, Ann. N. Y. Acad. Sci. 1116 (1) (2007) 182–195.
8- O.P. Lazarenko, S.O. Rzonca, W.R. Hogue, F.L. Swain, L.J. Suva, B. Lecka-Czernik, Rosiglitazone induces decreases in bone mass and strength that are reminiscent of aged bone, Endocrinology. 148 (6) (2007) 2669–2680.
9- Y.-S. Lee, Y.-S. Kim, S.-Y. Lee, G.-H. Kim, B.-J. Kim, S.-H. Lee, K.-U. Lee, G.-S. Kim, S.-W. Kim, J.-M. Koh, AMP kinase acts as a negative regulator of RANKL in the differentiation of osteoclasts, Bone. 47 (5) (2010) 926–937.
10- Jang WG, Kim EJ, Bae IH et al (2011) Metformin induces osteoblast differentiation via orphan nuclear receptor SHP-mediated transactivation of Runx2. Bone 48:885–893.
11- Zhou Z, Tang Y, Jin X et al (2016) Metformin inhibits advanced glycation end products-induced inflammatory response in murine macrophages partly through AMPK activation and RAGE/NFkappaB pathway suppression. J Diabetes Res 2016:4847812.
Evaluation of endometrial progesterone receptor expression after 12 weeks of exposure to a low-dose vaginal estradiol insert
Sebastian Mirkin y colaboradores.
Menopause, Vol. 28, No. 9, 2021
DOI: 10.1097/GME.0000000000001801
ESTE BOLETÍN FUE REALIZADO CON LA VALIOSA COOPERACIÓN DEL DR. SEBASTIAN MIRKIN
La vagina es una cavidad músculo elástica, de aproximadamente 10 cm de longitud que posee dos orígenes embriológicos. La porción superior de la vagina y el útero son de origen mülleriano. La porción inferior de la vagina, uretra, vulva, vestíbulo y el introito derivan del seno urogenital. Estos últimos, poseen la mayor expresión de receptores de estrógeno. Durante la menopausia los niveles séricos de estrógeno disminuyen por debajo de los 7pg/mL produciendo una marcada atrofia de los tejidos derivados del seno urogenital. Como consecuencia de esta atrofia, se manifiestan una variedad de síntomas y signos denominados síndrome genitourinario de la menopausia (GSM) (1).
La administración de drogas por vía vaginal es una alternativa terapéutica de uso frecuente en la endocrinología reproductiva. La parte superior de la vagina facilita la absorción sistémica de drogas y es utilizado como vía de administración de esteroides, por ejemplo los anillos vaginales de uso en anticoncepción. La parte superior de la vaginal también facilita la llegada de esteroides al endometrio a través de un sistema porta contracorriente (primer paso uterino), los progestágenos por esta vía logran concentraciones endometriales mucho mayor que las concentraciones sistémicas. Cuando las drogas se aplican en la porción inferior de la vagina, se minimiza la absorción sistémica, facilitando la absorción y la distribución hacia los tejidos derivados del seno urogenital, como la vulva y la uretra (2)
Los estrógenos vaginales son la terapia de elección para el tratamiento del GSM. Existen diferentes preparados comerciales de 17β estradiol y de estrógenos conjugados equinos en forma de cremas, tabletas y óvulos vaginales. Las dosis de estos preparados varían desde los 4 microgramos hasta los 325 microgramos. Las cremas y las tabletas vaginales se insertan con un aplicador en la parte superior de la vagina, mientras que los óvulos vaginales son colocados en la parte inferior de la vagina en forma manual.
Una reciente revisión sistemática postula que la aplicación de estrógenos vaginales para el tratamiento del GSM debería realizarse en la parte inferior de la vagina, ya que de esa forma se reducen las dosis de estrógenos utilizados, se minimiza la absorción sistémica y se elimina la posibilidad de estimulación endometrial a través del primer paso uterino (1, 3).
Los receptores de progesterona (RP) se expresan en el endometrio y son un marcador genómico muy sensible. Muy bajas concentraciones de estrógenos estimulan la expresión de los RP en el endometrio. Este marcador tiene un alto valor predictivo para evaluar la estimulación estrogénica en el endometrio (4).
Mirkin y colaboradores evaluaron el efecto de un óvulo vaginal (Imxexxy) que contiene 17β estradiol, en la expresión de RP a través de biopsias endometriales obtenidas en mujeres postmenopáusicas tratadas por tres meses. Estos óvulos vaginales poseen una membrana mucoadhesiva que hace que se adhieran a la mucosa vaginal y se colocan digitalmente en la parte inferior de la vagina. La temperatura y la humedad vaginal hacen que el óvulo se disuelva en menos de 6 horas (5).
Se evaluaron dos dosis de estrógeno (4 y 10 mcg) y ninguna de ellas produjo aumento de la expresión de PR. Los autores concluyeron que el uso de óvulos vaginales con ultra bajas dosis de estrógenos, colocados en la parte inferior de la vagina, no producen estimulación estrogénica endometrial. Estos resultados son relevantes, cuando el objetivo es la seguridad endometrial (5). Actualmente, se están realizando estudios clínicos de larga duración (3-5 años) evaluando la seguridad endometrial de los estrógenos vaginales (6).
Bibliografía
- Liu JH, Bernick, Mirkin S. Estradiol softgel inserts for the treatment of VVA symptoms: an expert opinion. Expert Opin Drug Deliv 2020;17:1573-1581.
- Alexander N et al., Why consider vaginal drug administration? Fertil Steril 2004;82:1-12
- Biehl C, Plotsker O, Mirkin S. A systematic review of the efficacy and safety of vaginal estrogen products for the treatment of Genitourinary Syndrome of Menopause. Menopause 2019;26:431-453.
- Mirkin S, Hsiu JW, Nikas G, Diaz J, Oehninger S. Comparison of gene expression profiles and other structural/functional features of the endometrium during the window of implantation in timely-matched natural and gonadotropin-stimulated cycles. J Clin Endocrinol Metab 2004; 89:5742-52.
- Mirkin S, Simon JA, Liu JH, Archer DF, Castro PD, Graham S, Bernick, Komm B. Evaluation of endometrial progesterone receptor expression after 12 weeks of exposure to a low-dose vaginal estradiol insert. Menopause 2021 [Online ahead of print].
- Graham S and Mirkin S. A Postmarketing Noninterventional Study Evaluating the Risk of Endometrial Cancer in Women Who Have Been Prescribed Vaginal Estrogens – Study Design. North American Menopause Society 2021 [Submitted]
NUEVOS ENFOQUES PARA LA RESTITUCIÓN DE LA FERTILIDAD EN MUJERES CON INSUFICIENCIA OVÁRICA PREMATURA
Novel approaches to fertility restoration in women with premature ovarian insufficiency
- Rosario & R. A. Anderson (2021): Novel approaches to fertility restoration in women with premature ovarian insufficiency, Climacteric, DOI: 10.1080/13697137.2020.1856806
To link to this article:https://doi.org/10.1080/13697137.2020.1856806
La pérdida de la fertilidad es la mayor preocupación de las mujeres jóvenes que presentan insuficiencia ovárica prematura (POI). Si bien la probabilidad de conseguir un embarazo espontáneo es baja pero no imposible, la donación de oocitos, representa la forma más exitosa de concepción.
Solo el 5% de las mujeres ovulan erráticamente y consiguen un embarazo en forma natural, sobre todo en los primeros estadios, lo que confirma la existencia de folículos primordiales remanentes.
Hay varias líneas de investigación en curso, con el objetivo de mejorar o restaurar la fertilidad en mujeres con POI.
Las alternativas terapéuticas diferentes a la ovodonación, comprenden el empleo de TRH (terapia de reemplazo hormonal), FIV (fecundación in vitro) o, más recientemente IVM (maduración in vitro) o terapia de stem cells. (1)
Uno de los estudios más importantes y con mayor cantidad de pacientes es el de Bachelot y colaboradores (2) en el año 2017, en el cual todas las mujeres recibieron tratamiento con terapia hormonal y el 3,6% logró un embarazo en el transcurso del mismo, demostrando la TRH como una estrategia válida para lograr el embarazo.
El uso terapéutico de stem cells pluripotenciales de origen mesenquimático (MSC) , como médula ósea, placenta, cordón umbilical y sangre menstrual, han dado buenos resultados en modelos animales con POI. Estas células tienen la capacidad de autorrenovarse y diferenciarse en tejidos específicos.
Las MSC pueden obtenerse por procesos mínimamente invasivos, no motivan problemas éticos, tienen baja inmunogenicidad y una función inmunomoduladora limitada; es aplicable a distintos tejidos dañados y empleado ampliamente en medicina regenerativa. Puede usarse con modelos in vitro de cultivos celulares con gran estabilidad genómica. (3)
La asociación con plasma enriquecido en plaquetas, fuente rica en factores de crecimiento, se está estudiando en la actualidad. Esta es una preparación autóloga de plasma humano concentrado, con múltiples factores de crecimiento y citokinas, que tienen el potencial de cicatrización en sitios de injuria y que se emplea en distintas situaciones en medicina.
El empleo de plasma enriquecido, aumenta el crecimiento y sobrevida de los folículos preantrales aislados, de cultivos de tejidos frescos o vitrificados (4)
Numerosos estudios han confirmado el potencial reparador de la infusión/ transplante de las MSC en modelos animales con POI . Estos se enfocan en aspectos de la función ovárica incluyendo desarrollo folicular, apoptosis de células de la granulosa, neo angiogénesis, niveles hormonales séricos y lo más interesante índices de embarazo.
La menopausia o la POI no significan la ausencia completa de folículos primordiales; alrededor de 1000 folículos persisten en el ovario en la menopausia natural y la activación de éstos, está en investigación.
La manipulación física o química de caminos regulatorios de la phosphoinositide 3-kinase (PI3K)/AKT/mammalian target de rapamycin (mTOR) y de la Hippo, tienen el potencial de activación de los folículos primordiales. Ya se han obtenido en humanos un pequeño número de embarazos. (5)
Ding y colaboradores (6) utilizaron de forma aleatoria la inyección de stem cell de cordón umbilical en ovario + colágeno ovárico + terapia hormonal vs stem cell de cordón umbilical en ovario + terapia hormonal en 14 pacientes con diagnóstico de POI. Se lograron dos embarazos, uno en cada grupo, un 14,2% de las pacientes estudiadas, teniendo en cuenta la limitación del bajo número de pacientes. Otros trabajos evaluaron la IVM (maduración in vitro) y el uso de stem cells más terapia hormonal, como por ejemplo el de Kawamura y col. (7), en el cual 27 pacientes participaron y 2 lograron embarazo, solo 1 llegó a término (7,4% de embarazos).
Otro enfoque que también está en estudio es el uso de corticoesteroides. La hipótesis de su uso está dada por la posibilidad de que las mujeres con POI sean resultado de una enfermedad autoinmune, dado que muchas pacientes también presentan trastornos autoinmunes coexistentes. Se cree que estas pacientes estarían beneficiadas porque los corticoides disminuirían los macrófagos inflamatorios folículares, lo cual ayudaría hipotéticamente a la foliculogénesis de folículos latentes. Badawy y col. realizó un ECA donde se observó que la tasa de ovulación fue significativamente más alta en el grupo tratado con dexametasona. El número de pacientes del estudio fue bajo y también se utilizó un agonista GnRH , por lo tanto es difícil atribuir el beneficio solamente al corticoide. (8)
RESUMEN DE LOS DISTINTOS ENFOQUES PARA MEJORAR FERTILIDAD EN MUJERES CON POI
Conclusiones
No existe hasta el momento un tratamiento que muestre mayor superioridad para la infertilidad en pacientes POI. La TRH continúa siendo el tratamiento de elección para optimizar salud ósea y cardiovascular, pero no puede considerarse un tratamiento para fertilidad. Los recientes avances en IVM y en terapia con stem cells parecen ser la nueva esperanza para estas pacientes.
BIBLIOGRAFIA
1- Premature ovarian failure: A systematic review on therapeutic interventions to restore ovarian function and achieve pregnancy. Van Kasteren, Y. M. Human Reprod Update 1999; 5: 483 – 492.
2- Long-term outcome of ovarian function in women with intermittent premature ovarian insufficiency. Anne Bachelot. Clinical Endocrinology (2017) 86, 223–228 doi: 10.1111/cen.13105.
3- Mesenchymal stem cell perspective: cell biology to clinical progress.Pittenger MF, Discher DE, P-eault BM, et al. NPJ Regen Med 2019; 4:22.
4- Platelet-rich plasma promotes the development of isolated human primordial and primary follicles to the preantral stage.Hosseini L, Shirazi A, Naderi MM, et al. Reprod Biomed Online 2017;35: 343–50.
5- Primordial follicle activation as a new treatment for primary ovarian insufficiency. Lee HN, Chang EM. Clin Exp Reprod Med 2019;46: 43–9.
6- Transplantation of UC-MSCs on collagen scaffold activates follicles in dormant ovaries of POF patients with long history of infertility. Lijun Ding. Science China Life Sciences volume 61, 1554–1565 (2018).
7- Hippo Signaling Disruption and Akt Stimulation of Ovarian Follicles for Infertility Treatment. Kawamura et al. Proceedings of the National Academy of Sciences 2013; 110: 17474–17479.
8- Induction of ovulation in idiopathic premature ovarian failure: a randomized double-blind trial. A Badawy. Reproductive BioMedicine Online. Volume 15, Issue 2, 2007, Pages 215-219.
OSTEOPOROSIS EN EL VARÓN
INTRODUCCIÓN
La osteoporosis es una enfermedad en constante crecimiento que afecta a más de 200 millones de personas en todo el mundo y es la causante de fracturas por fragilidad tanto en hombres como en mujeres. Se la denomina enfermedad silenciosa, ya que debuta con una fractura (en ese caso ya se trata de una osteoporosis establecida) con serias consecuencias en la salud de estos pacientes. La incidencia de fracturas osteoporóticas difiere en hombres y mujeres.
Un estudio epidemiológico mostró que la incidencia de fracturas vertebrales aumenta rápidamente en la mujer después de los 55 años, mientras que este fenómeno ocurre después de los 65 años en varones. En cuanto a las fracturas de cadera, la incidencia muestra que la curva aumenta rápidamente a los 65 años en la mujer y 75 años en el varón (1).
El riesgo de fractura de cadera en los hombres ancianos es del 5 al 6%, en comparación con el 16 al 18% para las mujeres (2). Esto significa que el 30% de todas las fracturas de cadera afectan a los hombres y se asocia con mayor morbimortalidad (3). Se estima que un hombre de 50 años tiene un riesgo del 13 al 25% de sufrir fractura por fragilidad (2).
La escasez de trabajos científicos publicados, muestra que la osteoporosis masculina está subestimada, subdiagnosticada y subtratada, tanto en lo referente a prevención primaria como secundaria de fracturas por fragilidad (3).
FISIOPATOLOGÍA
La pérdida de masa ósea a lo largo de la vida se debe a un disbalance entre la formación y la resorción ósea. Las mujeres tienen un mayor riesgo de sufrir fracturas por fragilidad que los hombres debido a que sus huesos son de diámetro más pequeño, el proceso de resorción ósea es más temprano y hay mayor riesgo de caída (3). La pérdida de hueso trabecular comienza en los hombres mucho antes de la mediana edad, mientras que la pérdida de hueso cortical ocurre principalmente después de los 65 años (2). Curiosamente, los hombres con osteoporosis que sufren fracturas por fragilidad tienen una mayor pérdida de conectividad trabecular que los hombres con osteoporosis sin fracturas (3).
Como consecuencia de la edad, aumenta el número de caídas por diversos factores: debilidad muscular, alteraciones visuales, trastornos del equilibrio y del sueño, toma de medicamentos, etc.
Los esteroides sexuales juegan un papel importante en la regulación de la homeostasis ósea y preservación de la integridad esquelética.
Los andrógenos (testosterona y la dihidrotestosterona) tienen un efecto anabólico sobre la masa ósea, con un estímulo en la aposición perióstica y con aumento en el tamaño y la fuerza del hueso. Por otro lado, también tienen un efecto importante en el desarrollo de la masa muscular y el equilibrio, reduciendo el riesgo de caídas (3).
Sin embargo, el principal efector en la preservación de la salud ósea es el estradiol (producto de la aromatización de la testosterona) a través de la vía del receptor alfa. Varios estudios sugieren que la mayor pérdida de masa ósea se debe a valores aumentados de SHBG (globulina transportadora de esteroides sexuales) independientemente de los valores de testosterona y estradiol ya que disminuye la biodisponibilidad de ambos (2, 3).
En resumen, tanto los bajos niveles de estradiol como la SHBG alta se asocian de forma independiente con una mayor tasa de pérdida ósea y mayor riesgo de fractura, mientras que la testosterona baja puede tener un mayor efecto sobre el riesgo de fractura, posiblemente a través de un mayor riesgo de caídas (2).
Valores menores a 20 ng/ml de vitamina D en adultos mayores se asocian con aumento en el número de caídas, mayor pérdida de masa ósea en cadera, mayor riesgo de fractura de cadera y fracturas osteoporóticas. El hiperparatiroidismo secundario y el descenso de IGF-1 también alteran el metabolismo óseo (2).
DIAGNÓSTICO
Los pacientes con osteoporosis son asintomáticos hasta que padecen una fractura por fragilidad. De esta manera, es posible realizar el diagnóstico clínico de osteoporosis.
Por analogía, y dada la escasez de estudios prospectivos que evalúan la relación entre la DMO y el riesgo de fractura en los hombres, la osteoporosis en los hombres también ha sido definida como un T score de DMO ≤ – 2.5. Sin embargo, no hay consenso sobre si el T score en los hombres debe calcularse teniendo como referencia a los valores de un hombre joven o a la población de referencia femenina (20-29 años) (2, 3).
Tanto el riesgo de fractura de cadera como el riesgo de fractura vertebral es similar en hombres y en mujeres para cualquier valor absoluto de DMO. Así, un hombre y una mujer de la misma edad con la misma DMO tienen un riesgo similar de fractura (aún considerando las diferencias subyacentes en el tamaño y la estructura del hueso). Este enfoque figura en las guías de la Fundación Internacional de Osteoporosis (IOF) (2), la Sociedad Internacional de Densitometría Clínica (ISCD) (2) y la Organización Mundial de la Salud (OMS) (3), y da como resultado una menor incidencia de osteoporosis en hombres (2).
Una postura diferente tienen la Sociedad de Endocrinología (EEUU) y la Fundación Nacional de Osteoporosis (EEUU), quienes sostienen que se debe utilizar una población de referencia de varones adultos jóvenes para calcular el T score. De esta manera quedarían incluidos un mayor porcentaje de hombres con osteoporosis (más comparable a la de mujeres), pero con un menor riesgo de fractura. Una proporción sustancial de las fracturas se producen en hombres con valores de DMO más altos. La mayor parte de los ensayos clínicos de validación de los tratamientos para la osteoporosis en el varón, toman como referencia el T score de la población masculina (2).
Para estimar el riesgo de fractura a 10 años se propone el uso del FRAX™ y del monograma de Garvan, que combinan los factores de riesgo (tabaquismo, bajo IMC, fracturas previas, uso de glucocorticoides, entre otros) con o sin los valores de DMO de cadera. Los resultados para una intervención terapéutica pueden variar, pero en promedio se puede decir que es del 20% para todas las fracturas mayores y del 3% para la fractura de cadera (2).
Es importante destacar, que la principal causa de osteoporosis en hombres es la causa secundaria (65% vs 20-40% en mujeres) (3). Las principales son: uso de glucocorticoides, hipogonadismo, EPOC, hiperparatiroidismo primario, post-trasplante, mieloma múltiple, inmovilización (Parkinson, ACV), alcoholismo, deprivación de andrógenos por cáncer prostático, etc (2). Por lo tanto, una vez realizado el diagnóstico y establecido el riesgo de fractura, se debe solicitar un laboratorio completo, metabolismo fosfocálcico y los estudios complementarios necesarios según el diagnóstico presuntivo de la causa (3).
TRATAMIENTO
Ante un paciente con riesgo aumentado de fracturas, es vital destacar la importancia de una alimentación balanceada (con una ingesta adecuada de proteínas y calcio), mantener un peso acorde, realizar actividad física, evitar caídas, suplementar con vitamina D y desalentar el consumo de alcohol y tabaco.
Respecto al tratamiento farmacológico, hay poca evidencia científica en reducción de riesgo de fracturas. Los bifosfonatos son considerados fármacos de elección de primera línea (2).
Las drogas aprobadas para el tratamiento son: alendronato, risedronato, zoledronato, denosumab y teriparatide. Todos previenen fracturas vertebrales con un grado de evidencia A. El risedronato es el único con grado de evidencia A para la prevención de fracturas tanto vertebrales, cadera y no vertebrales (3).
CONCLUSIÓN
Como la osteoporosis es esencialmente una patología de la mujer postmenopáusica, los profesionales de la salud tienden a subestimar la fractura en el varón.
Como consecuencia, el diagnóstico es tardío y pocos reciben un tratamiento adecuado.
Claramente, hay mucho trabajo por delante: identificar a los hombres de edad avanzada con alto riesgo de fractura haciendo foco en los factores de riesgo señalados y realizar más trabajos de investigación, para ofrecer mejores recursos a una población creciente de adultos mayores.
BIBLIOGRAFÍA
- Nordström, P.; Eklund, F.; Bjornstig, U.; Nordström, A.; Lorentzon, R.; Sievanen, H.; Gustafson, Y. Do both areal BMD and injurious falls explain the higher incidence of fractures in women than in men? Calcif. Tissue Int. 2011, 89, 203–210.
- Kaufman, Jean‑Marc. Management of osteoporosis in older men. Aging Clinical and Experimental Research (2021) 33:1439–1452. https://doi.org/10.1007/s40520-021-01845-8.
Rinonapoli, G.; Ruggiero, C.; Meccariello, L.; Bisaccia, M.; Ceccarini, P.; Caraffa, A. Osteoporosis in Men: A Review of an Underestimated Bone Condition. Int. J. Mol. Sci. 2021, 22, 2105. https:// doi.org/10.3390/ijms220
TERAPIA HORMONAL CON COMPUESTOS BIOIDÉNTICOS
RECOMENDACIONES DE LA ACADEMIA NACIONAL DE CIENCIAS
Compounded bioidentical hormone therapy: new recommendations from the 2020 National Academies of Sciences, Engineering, and Medicine. Cynthia A. Stuenkel, MD, NCMP
Menopause: The Journal of The North American Menopause Society Vol. 28, No. 5, pp. 576-578 DOI: 10.1097/GME.0000000000001735 2021 by The North American Menopause Society
Las hormonas bioidénticas (BH) son formulaciones que contienen la misma estructura química y molecular que las hormonas endógenas humanas. Están aprobadas por la FDA y disponibles para su uso como terapia hormonal (BTH)
Es importante diferenciarlas de los compuestos preparados, comercializados como bioidénticos, no aprobados por los entes reguladores, cuyo contenido es incierto. Años atrás, el marketing de lo bioidéntico, era restringido únicamente a la TH y se promocionaba con la etiqueta de compuestos naturales.
El mercado actual comprende aproximadamente el 41% de las ventas en mujeres entre 40 a 49 años, aunque se calcula que es mayor (1).
La TH con compuestos bioidénticos (cBHT) aprobada por FDA incluye compuestos orales, transdérmicos y locales: estradiol vaginal, progesterona oral, progesterona micronizada vaginal, preparados orales combinados de estradiol más progesterona, testosterona transdérmica y pellets de testosterona (aprobados por FDA para el varón).
En la mujer, los andrógenos se prescriben como testosterona uso “off label” con la 1/10 dosis del varón, y prasterona vaginal(2).
Las preparaciones cBHT no han sido evaluadas para eficacia y seguridad en RCT, por lo tanto falta evidencia científica. Sin embargo, existen estudios observacionales y reporte de casos (3).
En septiembre de 2018 FDA y la Academia de Ciencias se asocian con el objetivo de evaluar la utilidad clínica de la cBTH, seguridad y eficacia. En Julio 2020, se informan las recomendaciones claves alineadas con la NAMS(4).
Perlitas del trabajo:
- Restringir el uso de preparaciones cBHT para casos de excepción (FDA aprueba la testosterona tritiada para mujeres)
- Informar a los pacientes de la seguridad y eficacia de estos preparados
- Informar a los pacientes que los compuestos bioidénticos están disponibles en distintas dosificaciones
- Alertar sobre el consumo de preparados de cBH no aprobados por entes regulatorios
- Necesidad de advertir en el etiquetado, los alertas para los consumidores de cBHT
- Reporte de efectos adversos a FDA
Cuando se indica tratamiento a un paciente, establecer tipo de cBHT, dosis, rutas de administración y duración. Evaluar historia clínica del paciente, riesgos y beneficios del tratamiento. Contraindicaciones comunes a la TH convencional: antecedente de historia de sangrado, con monitoreo de endometrio. En lo posible medir las hormonas basales y luego del año de inserción de un pellet.
BIBLIOGRAFIA
- Gass MLS, Stuenkel CA, Utian WH, LaCroix A, Liu JH, Shifren JL; North American Menopause Society (NAMS) Advisory Panel consisting of representatives of NAMS Board of Trustees and other experts in women’s health. Use of compounded hormone therapy in the United States: report of The North American Menopause Society survey. Menopause 2015;22:1276-1284.
- Davis SR, Baber R, Panay N, et al. Global consensus position statement on the use of testosterone therapy for women. Climacteric 2019;104:4660-4666.
- Grant MD, Marbella A, Wang AT, et al. Menopausal symptoms: comparative effectiveness of therapies. Rockville, MD: Agency for Healthcare Research and Quality (US); 2015. Report no. 15-EHC005-EF
- National Academies of Sciences, Engineering, and Medicine. The Clinical Utility of Compounded Bioidentical Hormone Therapy: A Review of Safety, Effectiveness, and Use. Washington, DC: The National Academies Press; 2020.
Ospemifeno en la práctica clínica: su efecto a nivel vaginal, endometrial y cambios en marcadores óseos
Vaginal health, endometrial thickness and changes in bone markers in postmenopausal women after 6 months of treatment with ospemifene in real clinical practice.
Carmen Pingarrón, Pilar Lafuente, Silvia Poyo Torcal, Helena López Verdú, María Sol Martínez García & Santiago Palacios (2021): Vaginal health, endometrial thickness and changes in bone markers in postmenopausal women after 6 months of treatment with ospemifene in real clinical practice, Gynecological Endocrinology, DOI: 10.1080/09513590.2021.1970740
To link to this article: https://doi.org/10.1080/09513590.2021.1970740
El ospemifeno es un modulador selectivo del receptor de estrógenos (SERM) que se ha utilizado como alternativa a la terapia hormonal local o sistémica en la atrofia vulvovaginal (AVV). (1, 2) Ha demostrado tener un efecto neutro en el grosor endometrial y una disminución del recambio óseo. (3,4) Se encuentra contraindicado en mujeres con antecedente de eventos tromboembólicos, antecedente de cáncer de mama o cualquier otro tumor hormono dependiente, en sangrados vaginales sin causa aparente o en pacientes con hiperplasia endometrial. (5)
La AVV es una condición frecuente y poco notificada en la consulta médica, se observa principalmente en mujeres postmenopáusicas y se caracteriza por generar dispareunia, ardor, prurito y sequedad vaginal. En la AVV leve se utilizan con frecuencia lubricantes y humectantes, pero cuando resulta insuficiente se recomienda terapia hormonal local con estrógenos. (6, 7, 8)
La eficacia del ospemifeno para el tratamiento de AVV fue probada por tres estudios clínicos doble ciego controlados con placebo: dos de seguimiento a 12 semanas con nivel de eficacia fase III (1, 2) y otro a 52 semanas también fase III (9).
El AYSEX es un estudio prospectivo y observacional del cual participaron 5 ginecólogos de un centro médico de España. Se reclutaron 100 mujeres postmenopáusicas con diagnóstico de AVV, las cuales recibieron una dosis de 60 mg de ospemifeno por día durante 12 meses. Se observó a los 3 meses que el pH vaginal disminuyó de 6.1 a 4.5 (p < .0001) como así también el Vaginal Health Index que disminuyó del 100% al 5.2% (p < .0001).
Luego de 6 meses los valores de CTx (beta crosslaps) presentaron un descenso de 0.42 pg/ml a 0.37 pg/ml (p = 0 .0018). Mientras que el grosor endometrial se modificó de 2.24 a 2.15mm (p= .6066).
A pesar de que el ospemifeno no está aprobado para prevenir o tratar la osteoporosis, diferentes estudios aprueban su papel en el mantenimiento de la salud ósea sin las complicaciones tromboembólicas observadas en otros SERMs. Este estudio confirma lo anteriormente dicho al demostrar la disminución de CTx. (10, 11)
Las críticas al estudio son la falta de grupo de control y que solamente fue evaluado el CTx como marcador de resorción ósea.
Como conclusión se puede afirmar que el ospemifeno mejora todos los dominios del Vaginal Health Index, disminuye los valores de CTx y no incrementa el grosor endometrial.
1- Bachmann GA, Ospemifene Study Group, Komi JO. Ospemifene study G. Ospemifene effectively treats vulvovaginal atrophy in postmenopausal women: results from a pivotal phase 3 study. Menopause. 2010;17(3):480–486.
2- Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013;20(6): 623–630.
3- Simon JA, Lin VH, Radovich C, et al. One-year long-term safety extension study of ospemifene for the treatment of vulvar and vaginal 4 C. PINGARRÓN ET AL. atrophy in postmenopausal women with a uterus. Menopause. 2013; 20(4):418–427.
4- Komi J, Heikkinen J, Rutanen EM, et al. Effects of ospemifene, a novel SERM, on biochemical markers of bone turnover in healthy.
5- European Medicine Agency. Senshio: EPAR – Product Information. Last updated Nov 2019 [Internet]. European Medicine Agency. 2018. [cited 2019 Nov 20]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/senshio.
6- Mac Bride MB, Rhodes DJ, Shuster LT. Vulvovaginal atrophy. Mayo Clin Proc. 2010;85(1):87–94. Jan.
7- Palacios S, Cancelo Hidalgo MJ, Gonzalez SP, et al. Genitourinary syndrome of menopause: recommendations from the Spanish society of obstetrics and gynecology. Prog Obstet Ginecol. 2019;62(2): 141–148.
8- Moreira ED, Glasser DB, Nicolosi A, et al. Sexual problems and helpseeking behaviour in adults in the United Kingdom and continental Europe. BJU Int. 2008;101(8):1005–1011.
9- Goldstein SR, Bachmann GA, Koninckx PR, et al. Ospemifene 12-month safety and efficacy in postmenopausal women with vulvar and vaginal atrophy. Climacteric. 2014;17(2):173–182.
10- Palacios S, Silverman SL, de Villiers TJ, et al. A 7-year randomized, placebo-controlled trial assessing the long-term efficacy and safety of bazedoxifene in postmenopausal women with osteoporosis: effects on bone density and fracture. Menopause. 2015;22(8):806–813.
11- Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple outcomes of raloxifene evaluation (MORE) investigators. JAMA. 1999;282(7):637–645.
20 OCTUBRE DIA MUNDIAL DE LA OSTEOPOROSIS
DIETA LÁCTEA Y SALUD ÓSEA
Dairy products and bone health
René Rizzoli
Aging Clinical and Experimental Research https://doi.org/10.1007/s40520-021-01970-4
Las funciones del esqueleto son de soporte, protección de los órganos internos, homeostasis mineral y regulación ácido-base. La fuerza ósea depende de la masa ósea, la geometría, microestructura y la calidad de los materiales que lo constituyen.
El máximo capital óseo (pico masa ósea) se consolida al final de la segunda década de la vida y los factores genéticos aportan el 60 al 80% de su variabilidad.
Los factores ambientales pueden modificar el peso de la genética, al deteriorar la masa ósea y el turnover óseo y/o la fuerza ósea, con el consiguiente aumento del riesgo de fractura.
Las deficiencias nutricionales alteran el crecimiento del hueso. Nutrientes como el calcio, fósforo y las proteínas son imprescindibles para obtener una buena masa ósea. Los productos lácteos aportan estos nutrientes y muchos vienen fortificados con vitamina D.
Un litro de leche de vaca provee 1200 mg/l de calcio, 1150 mg/l fósforo, 32-35 g/l de proteína como la caseína, que contiene factores de crecimiento celulares, proteínas y vitaminas.
Los productos lácteos aportan el 50-60% de calcio y 20-30% de proteínas durante el crecimiento. La carencia de éstos, se asocia con un riesgo aumentado de fractura de 4.6 veces, en niñas de 2 a 20 años. En protocolos de intervención de corta duración, los lácteos han demostrado reducir los marcadores de turnover óseo y los niveles de PTH en adultos jóvenes y mayores.
La ingesta de lácteos es importante en la mujer gestante. La BMD de los niños a los 6 años de edad, se correlaciona en forma positiva con el consumo de lácteos de la madre durante el embarazo. Esos niños y adolescentes alcanzan mejores picos de masa ósea, pero no serían un determinante de la estatura final.
En una revisión sistemática de protocolos randomizados durante la infancia y adolescencia, se demostró una ganancia de 8% de BMD con suplementación a lo largo de 16 meses. También se ha reportado aumento de masa magra en otro metaanálisis.
Por otro lado, la adecuada suplementación con fosfatos, es necesaria para el cartílago y la mineralización del tejido osteoide. Los síndromes con pérdida de fosfatos se asocian con alteración del crecimiento y fracturas por fragilidad.
En estudios observacionales, el aporte de lácteos, sobre todo los fermentados, han demostrado asociarse a una disminución del riesgo de fractura.
Los lácteos son una fuente de ácidos grasos saturados, motivo por el cual muchos metaanálisis incluidos en guías nutricionales los desaconsejan por el riesgo aumentado de enfermedad cardiovascular. Sin embargo, recientemente se ha encontrado que no siempre los ácidos grasos saturados ejercen dichos efectos adversos, dependiendo de los efectos biológicos de la matriz del nutriente. Por ejemplo, a pesar de tener altos niveles de ácidos grasos saturados, se observó que los quesos disminuyen el riesgo de enfermedad cardiovascular y stroke.
En un extenso estudio de cohorte en adultos de 35 a 70 años, la ingesta elevada de productos lácteos (mayor a 2 porciones diarias), disminuyó el riesgo de mortalidad total.
BIBLIOGRAFIA
- Arnold A, Dennison E, Kovacs CS et al (2021)
Hormonal regulation of biomineralization. Nat Rev Endocrinol 17:261–275
- Marcucci G, Masi L, Ferrarì S et al (2018)
Phosphate wasting disorders in adults. Osteoporos Int 29:2369–2387
3- Kouvelioti R, Josse AR, Klentrou P (2017)
Effects of dairy consumption on body composition and bone properties in youth: a systematic review. Curr Dev Nutr 1:e001214
- Geiker NRW, Mølgaard C, Iuliano S et al (2020)
Impact of the whole dairy matrix on musculoskeletal health and aging-current knowledge and research gaps. Osteoporos Int 31:601–615
- Cheng S, Lyytikainen A, Kroger H et al (2005)
Effects of calcium, dairy product, and vitamin D supplementation on bone mass accrual and body composition in 10–12-y-old girls: a 2-y randomized trial. Am J Clin Nutr 82:1115–1126
6-de Souza RJ, Mente A, Maroleanu A et al (2015)
Intake of saturated and trans unsaturated fatty acids and risk of all cause mortality, cardiovascular disease, and type 2 diabetes: systematic review and meta-analysis of observational studies. Bmj 351:h3978
- Dehghan M, Mente A, Rangarajan S et al (2018) Association
of dairy intake with cardiovascular disease and mortality in 21
countries from five continents (PURE): a prospective cohort
study. Lancet 392:2288–2297
Herramientas para la atención de la insuficiencia ovárica primaria
Premature ovarian insufficiency: a toolkit for the primary care physician
- Lambrinoudaki, S. A. Paschou, M. A. Lumsden, S. Faubion, E. Makrakis, S. Kalantaridou & N. Panay
Climacteric 2021, VOL. 24, NO. 5, 425–437, DOI: 10.1080/13697137.2020.1859246.
La insuficiencia ovárica primaria (IOP) es el cese temporario o permanente de los ciclos menstruales en una mujer menor de 40 años. Ocurre en el 1% de las mujeres en edad reproductiva y su diagnóstico conlleva consecuencias físicas y emocionales tanto para la paciente como para su familia. Debemos tener en cuenta ciertos parámetros para llegar al diagnóstico (1):
- exhaustiva HC con antecedentes personales y familiares; tener en cuenta el antecedente familiar de IOP.
- descartar posibles causas secundarias de IOP, como desórdenes genéticos, infecciones (TBC), cirugías, medicaciones, quimio o radioterapia.
- alteración de los ciclos menstruales: oligo – amenorrea que puede ser intermitente o permanente.
- dos valores de FSH>25 UI/l por lo menos con 4-6 semanas de diferencia para confirmar el mismo.
Los síntomas son los característicos del hipoestrogenismo como los síntomas vasomotores, atrofia vulvovaginal, sequedad vaginal, dispareunia, como así también alteraciones del sueño, alteraciones cognitivas, cambios en el estado de ánimo, baja líbido y aumento de peso.(2) Se produce una reducción del conjunto de folículos primordiales, lo cual puede deberse a una atresia o una reducción folicular acelerada como así también por una alteración del reclutamiento o maduración de los folículos primordiales.
A pesar de que en muchos casos se puede determinar la etiología , en otros permanece desconocida. Existen factores genéticos, autoinmunes, iatrogénicos y ambientales que pueden precipitar la IOP
Los estudios diagnósticos que se recomiendan son: cariotipo, gen X frágil, anticuerpos 21-hidroxilasa y pruebas de función adrenal si los mismos son positivos, anticuerpos antiperoxidasa tiroidea, otros anticuerpos solo si lo ameritan los antecedentes personales y familiares.(3, 4, 5) Tener en cuenta que la anomalía genética más común en IOP es la premutación FMR1 (gen del X frágil)
El tratamiento consiste principalmente en la terapia hormonal de reemplazo, la cual debe realizarse hasta la edad normal de menopausia natural, aproximadamente hasta los 51 años. Se debe considerar la utilización en conjunto de terapia vaginal hormonal local para los síntomas de atrofia vulvovaginal.
El uso de anticoncepción hormonal combinada como THR es una opción bien aceptada por las mujeres jóvenes . El uso continúo evita síntomas de hipoestrogenismo y previene descenso de masa ósea. (6, 7) Siempre tener en cuenta el riesgo aumentado de trombosis venosa con la anticoncepción hormonal combinada. El uso de estradiol transdérmico tiene menor riesgo.
La THR debe individualizarse según la edad, las características y las necesidades y preferencias del paciente. Las mujeres más jóvenes pueden requerir una dosis de estrógenos más alta que las que se usan en mujeres mayores.
La terapia hormonal con andrógenos no está indicada en mujeres con IOP salvo aquellas que persistan con disfunción sexual a pesar de tener THR de forma adecuada. (8, 9)
El manejo de la fertilidad es diferente en mujeres con riesgo inminente de IOP que en aquellas que ya lo tienen establecido. En las primeras se debe intentar la concepción de forma natural en el caso de así desearlo u ofrecer la preservación de su fertilidad si no lo deseara en ese momento. En aquellas con diagnóstico de IOP se debe recordar que las posibilidades de embarazo espontáneo son menores del 25%, la preservación de óvulos o embriones no estaría indicada por su baja posibilidad de éxito. La mejor opción en estas mujeres es la ovodonación. (10)
Actualmente hay nuevas posibilidades en estudio para la fertilidad en IOP, como por ejemplo la activación in vitro de folículos latentes seguido de autotrasplante de tejido ovárico, así como también la identificación y manipulación de células madre provenientes de la corteza ovárica. (11, 12)
Bibliografía
1- Panay N, Anderson RA, Nappi RE, et al. Premature ovarian insufficiency: an International. Menopause Society White Paper. Climacteric 2020;23:426–46.
2- Maclaran K, Panay N. Current concepts in premature ovarian insufficiency. Womens Health (Lond Engl) 2015;11:169–82.
3- Jiao X, Qin C, Li J, et al. Cytogenetic analysis of 531 Chinese women with premature ovarian failure. Hum Reprod 2012;27: 2201–7.
4- Rossetti R, Ferrari I, Bonomi M, Persani L. Genetics of primary ovarian insufficiency. Clin Genet 2017;91:183–98.
5- Silva CA, Yamakami LY, Aikawa NE, et al. Autoimmune primary ovarian insufficiency. Autoimmun Rev 2014;13:427–30.
6- Cartwright B, Robinson J, Seed PT, Fogelman I, Rymer J. Hormone replacement therapy versus the combined oral contraceptive pill in premature ovarian failure: a randomized controlled trial of the effects on bone mineral density. J Clin Endocrinol Metab 2016;101:3497–505.
7- Gazarra LBC, Bonacordi CL, Yela DA, Benetti-Pinto CL. Bone mass in women with premature ovarian insufficiency: a comparative study between hormone therapy and combined oral contraceptives. Menopause 2020;27:1110–16.
8- Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2014;99:3489–510.
9- Davis SR, Baber R, Panay N, et al. Global Consensus Position Statement on the use of testosterone therapy for women. Climacteric 2019;22:429–34.
10- Bidet M, Bachelot A, Bissauge E, et al. Resumption of ovarian function and pregnancies in 358 patients with premature ovarian failure. J Clin Endocrinol Metab 2011;96:3864–72.
11- Suzuki N, Yoshioka N, Takae S, et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod 2015;30:608–15.
12- Zhai J, Yao G, Dong F, et al. In vitro activation of follicles and fresh tissue auto-transplantation in primary ovarian insufficiency patients. J Clin Endocrinol Metab 2016;101:4405–12.
ASOCIACIÓN DE OOFORECTOMÍA BILATERAL EN MUJERES PREMENOPÁUSICAS CON DETERIORO COGNITIVO Y RIESGO DE DESORDEN MODERADO COGNITIVO
Association of Premenopausal Bilateral Oophorectomy With Cognitive Performance and Risk of Mild Cognitive Impairment
Walter A. Rocca, MD, MPH; Christine M. Lohse, MS; Carin Y. Smith, BS; Julie A. Fields, PhD; Mary M. Machulda, PhD; Michelle M. Mielke, PhD
JAMA Network Open. 2021;4(11):e2131448. Doi:10.1001
La hipótesis de la asociación entre ooforectomía bilateral en mujeres premenopáusicas y el envejecimiento cerebral tiene una historia de más de una década.
En 2007 Rocca (1) publica los primeros datos de mujeres ooforectomizadas antes de los 49 años y la asociación con riesgo elevado de desórdenes cognitivos y demencia, riesgo que se revierte cuando se emplea terapia estrogénica (TE).
Estudios posteriores realizados en Dinamarca (2) y Francia (3), reportan similares resultados empleando TE en este grupo de mujeres.
En 2019, se publicó un primer metaanálisis (4) con 11 estudios de los cuales dos, hicieron foco en la asociación entre ooforectomía bilateral antes de los 46 años y el riesgo de deterioro cognitivo o demencia (5). Este metaanálisis encontró un riesgo aumentado de 70%.
El presente trabajo es un estudio de cohorte en una población de 2732 mujeres entre 50 a 89 años en Olmstead, Minessota. Se realizó un estudio caso- control y otro transversal combinando los datos del Mayo Clinic Study of Aging (MCSA) y el Rochester Epidemiology Project (REP) respectivamente. Todas las mujeres fueron ooforectomizadas antes de los 46 años. Se les realizó evaluación clínica entre 2004 y 2019, y tests cognitivos.
En el estudio de control de casos, hubo un incremento significativo de deterioro cognitivo moderado. En el transversal realizado en la misma población, hubo disminución de los scores de cognición global, de atención y dominio ejecutivo y un screening cognitivo, cuando se lo comparaba con población no ooforectomizada.
Rocca en esta última publicación, describe los hipotéticos mecanismos mediante los cuales, se encuentra evidencia tan contundente entre castración quirúrgica temprana y cognición.
Habria 5 posibles interpretaciones: 1) la asociación no sería causal, y puede deberse a la coexistencia de variantes genéticas y ooforectomía a temprana edad. 2) la asociación puede ser causal y se debe a la abrupta y prolongada deprivación de los niveles circulantes de estrógenos . 3) la asociación puede ser causal debido a la abrupta disminución de los niveles circulantes de progesterona y testosterona. 4) la asociación puede ser causal, mediado por un aumento en la liberación de gonadotrofinas por la glándula pituitaria ( disrupción del eje H-H-O)
5) la asociación puede ser causal y mediado por complejas interacciones entre la deprivación estrogénica ( disrupción endocrina) variantes genéticas ( APOE genotipos) y otros factores de riesgo ( obesidad, tabaquismo).
En este último estudio de Rocca y col. el grupo de mujeres estudiadas, tenían factores de riesgo cardiovascular, enfermedad cardiaca y antecedente de ACV al momento que fueron evaluadas, comparadas con mujeres sin ooforectomía.
En un análisis adicional, después de la inclusión de los factores de riesgo CV u otros eventos, persistían iguales resultados. Por lo tanto, la asociación podría ser en parte por patología degenerativa cerebral, más que por patología cardiovascular.
Faltan aún más datos, que expliquen los mecanismos biológicos en distintos subgrupos de mujeres.
REFERENCIAS
- Rocca WA, Bower JH, Maraganore DM, et al. Increased risk of cognitive impairment or dementia in women who underwent oophorectomy before menopause. Neurology. 2007;69(11):1074-1083. doi:10.1212/01.wnl.
0000276984.19542.e6
- Phung TK, Waltoft BL, Laursen TM, et al. Hysterectomy, oophorectomy and risk of dementia: a nationwide historical cohort study. Dement Geriatr Cogn Disord. 2010;30(1):43-50. doi:10.1159/000314681
- Ryan J, Scali J, Carrière I, et al. Impact of a premature menopause on cognitive function in later life. BJOG. 2014; 121(13):1729-1739. doi:10.1111/1471-0528.12828
- Georgakis MK, Beskou-Kontou T, Theodoridis I, Skalkidou A, Petridou ET. Surgical menopause in association with cognitive function and risk of dementia: a systematic review and meta-analysis. Psychoneuroendocrinology 2019;106:9-19 doi:10.1016/j.psyneuen.2019.03.013
- Gervais NJ, Au A, Almey A, et al. Cognitive markers of dementia risk in middle-aged women with bilateralsalpingo-oophorectomy prior to menopause. Neurobiol Aging. 2020;94:1-6 doi:10.1016/j.neurobiolaging.2020. 04.019
INCIDENCIA DE CÁNCER TESTICULAR EN MUJERES TRANS CON TRATAMIENTO HORMONAL DE AFIRMACIÓN DEL GÉNERO (THAG): ESTUDIO HOLANDES DE COHORTE
Incidence of testicular cancer in trans women using gender-affirming hormonal treatment: a nationwide cohort study
de Nie I, Wiepjes CM, de Blok CJM, van Moorselaar RJA, Pigot GLS, van der Sluis TM, Barbé E, van der Voorn P, van Mello NM, Huirne J, den Heijer M. Incidence of testicular cancer in trans women using gender-affirming hormonal treatment: a nationwide cohort study. BJU Int. 2021 Aug 14. doi: 10.1111/bju.15575. Epub ahead of print. PMID: 34390620.
El cáncer testicular ocurre principalmente en hombres jóvenes (30 a 34 años). En Holanda tiene una incidencia de 9,5 por 100.000 hombres. Los tumores testiculares se clasifican en seminomas, no seminomas y tumores mixtos de células germinales. El pronóstico dependerá del grado histológico, localización del tumor, presencia de metástasis, nivel de marcadores tumorales. Sin embargo, la etiología del cáncer testicular sigue siendo incierto. Los factores de riesgo reconocidos para el cáncer testicular son antecedentes de criptorquidia, un bajo conteo espermático, presencia de un tumor contralateral o antecedentes positivos en familiares de primer grado.
Las personas de sexo masculino asignado al nacer que desean adecuar el cuerpo a la identidad y género autopercibidos, pueden recibir tratamiento hormonal para reafirmación de género o tratamiento hormonal cruzado (THC) y/o cirugía de afirmación de género (CAG). El protocolo de tratamiento hormonal consiste generalmente en el uso de antiandrógenos asociado a estrógenos, para lograr la feminización. En pacientes menores de 18 años (Etapa de Tanner ≥2) se suele emplear agonistas del GnRH para suprimir la pubertad. Hasta el 2014 Hasta 2014, existía una ley de esterilización en los Países Bajos para el reconocimiento legal de género.
En este estudio holandes, se buscó evaluar la incidencia de cáncer testicular en mujeres trans con THC. Se incluyeron 3026 mujeres trans bajo THC con una mediana de seguimiento 2,3 años (IQR 1,6–3,7). Se identificaron 2 casos (cáncer testicular) asociado a síntomas de masa escrotal y se encontró 1 caso de cáncer testicular en una muestra de orquidectomía (0,1%) en pacientes con un rango de edad entre la segunda y cuarta década de la vida sin factores de riesgo. La histología mostró un tumor no seminoma (teratoma maduro, 95 %; carcinoma embrionario, <5 %; y tumor del saco vitelino, <5 %), un seminoma puro en el segundo caso y un seminoma con células sincitiotrofoblásticas en el tercer caso. En el grupo de 523 mujeres trans con seguimiento a 5 años (IQR 6,4–13,9), no se observaron casos de cáncer testicular.
Estas observaciones sugieren que no hay diferencia en el riesgo de cáncer testicular entre mujeres trans que usan THC y hombres cis, por lo tanto estos resultados no respaldan la hipótesis de un efecto carcinogénico de la exposición posnatal a los estrógenos exógenos en el tejido testicular.
Por otro lado es posible que el diagnóstico de cáncer testicular en mujeres trans pueda retrasarse ya sea porque las pacientes ignoran o no se dan cuenta de alteraciones como masas testiculares o a que los médicos no se den cuenta de la presencia de testículos durante una consulta con una mujer fenotípica.
En conclusión, el presente estudio sugiere que el riesgo de cáncer testicular en mujeres trans bajo THC es comparable al riesgo en hombres cis, así como una exposición más prolongada a estrógenos exógenos en mujeres trans no aumenta el riesgo de desarrollar cáncer testicular.
Sin embargo, el conocimiento de la presencia de las gónadas en mujeres trans sigue siendo importante y se recomienda el autoexamen testicular regular.
|
|
|
|
|
|
HIPERANDROGENISMO POSMENOPÁUSICO
Postmenopausal hyperandrogenism
CLIMACTERIC 2022, VOL. 25, NO. 2, 109–117. https://doi.org/10.1080/13697137.2021.1915273
T. Yoldemir
En la posmenopausia, los niveles de estrógenos descienden rápidamente, mientras que los
niveles de andrógenos lo hacen de una manera gradual. Adicionalmente, existe un
descenso de la globulina ligadora de andrógenos y estrógenos (GLAE), SHBG por sus
siglas en inglés, con un incremento de los andrógenos libres biológicamente activos.
El hiperandrogenismo (HA) se asocia con descenso de los niveles de la lipoproteína de alta
densidad (HDL), incremento de los niveles de la lipoproteína de baja densidad (LDL) y de
los triglicéridos, con mayor incidencia de enfermedad cardiovascular, síndrome metabólico,
obesidad y diabetes en mujeres posmenopáusicas. El aumento en el índice de testosterona
/ estradiol está relacionado con alteración de la resistencia a la insulina y la hipertensión, así
como los altos niveles de testosterona en la mujer están relacionados con aumento en el
riesgo de cáncer de mama y enfermedad cardiaca.
Aunque el nivel normal para andrógenos en la mujer posmenopáusica no está definido, se
considera que deben ser inferiores a los valores hallados en mujeres premenopausicas. Por
lo tanto, se deberá sospechar causas tumorales con niveles de testosterona superiores a
100-140 ng/dl.
Se especula que la hiperinsulinemia presente en la insulinorresistencia, podría estimular la
luteinización estromal y estimular la producción de andrógenos en el ovario.
El diagnóstico del HA posmenopáusico debe basarse en la sospecha clínica, historia clínica
detallada (inicio, tiempo de evolución), y el examen físico detallado.
El hirsutismo, o crecimiento de vello terminal en zonas androgénicas como el mentón, labio
superior y abdomen, es uno de los síntomas que más disconfort general en las mujeres. Su
severidad es evaluada por el puntaje de Ferriman–Gallwey. Valores superiores a 8 es
diagnóstico de hirsutismo y deberá investigarse la causa. Sin embargo, está escala no está
aún validada para mujeres en la posmenopausia.
La virilización es la expresión más clara del HA que incluye al hirsutismo, apariencia
anabólica, engrosamiento de la voz, alopecia androgénica y clitoromegalia (> 1,5 mc x 2,5
cm)
Diagnóstico diferencial de HA en mujeres posmenopáusicas
1-SOP (Historia de ciclos anovulatorios
Hirsutismo o acné de larga data
Elevación de testosterona, DHEAS elevada (tiene a
mejorar con edad)
Imágenes ecográficas compatibles)
2-Hipertecosis (Forma más severa de SOP
Antecedentes de ciclos anovulatorios
Hiperandrogenismo de lenta progresión
Testosterona muy alta (> 150 ng/dl)
Insulinorresistencia e hiperinsulinemia
Ecografía: ovarios bilateralmente grandes
Otros hallazgos: obesidad central, acantosis
nigricans, estrías
3-Anovulación hiperandrogénica
inducida por obesidad
Antecedente de ciclos regulares antes del aumento
de peso
Testosterona elevada y/o DHEAS
4-Síndrome de Cushing Cortisol libre en orina elevado y/o supresión anormal
de 1 mg de dexametasona
Hipófisis: ACTH normal a elevada, DHEAS elevada
Suprarrenal: ACTH y DHEAS suprimidos
5-Hiperplasia suprarrenal congénita
(HSC)
Hirsutismo que aumenta con la edad
Clásica: 17-hidroxiprogesterona elevado
No clásica: 17-hidroxiprogesterona elevada después
de la estimulación con ACTH
6-Iatrogénico Testosterona, DHEA, DHEAS, androstenediona
LH y FSH pueden o no estar suprimida
Antiepilépticos (ácido valproico)
7-Tumor secretor de andrógenos
(ovárico o suprarrenal)
Antecedentes de menstruaciones regulares
Inicio rápido de síntomas virilizantes
Testosterona muy alta, DHEAS elevada
Dentro de las causas tumorales de HA en la posmenopausia se incluyen:
● Tumores secretores de esteroides sexuales○ Tecomas
○ Tumores de células estromales
○ Tumores de células del cordón sexual: correspondiendo al 5 a 8% de todas
las neoplasias ováricas, con un pico de incidencia alrededor de los 50 años.
Estos tumores tienen bajo potencial maligno, siendo la resección quirúrgica el
principal tratamiento.
○ Tumores de células de la granulosa: corresponde a 2 – 3% de los tumores
ováricos, presentándose en mujeres en la sexta década de la vida. Secretan
principalmente estrógenos produciendo sangrado, hiperplasia o carcinoma
endometrial. Sin embargo, > 10% pueden secretar andrógenos.
○ Tumores de células de Sertoli Leydig (androblastomas): corresponden a
menos del 0,5% de los tumores ováricos, generalmente son unilaterales y
causan virilización en un 35%. La mayoría de estos tumores son bien
diferenciados y el tratamiento es quirúrgico.
● Metástasis ováricas de tumores neuroendocrinos y otras neoplasias
● Tumores adrenales productores de andrógenos: generalmente secretan
prohormonas (DHEA, DHEAS y en menor proporción, testosterona). Su incidencia
es de 1-2 casos /millón de mujeres peri o postmenopausia. Usualmente son
malignos y causan virilización e hipercortisolismo en aproximadamente el 25% de los
casos.
Diagnóstico y evaluación del HA en la posmenopausia
El diagnóstico debe basarse en la sospecha clínica, historia detallada y el examen físico. Se
sugiere la medición inicial de testosterona y DHEAS temprano en la mañana. El nivel de
testosterona libre se puede estimar midiendo la testosterona total y el nivel de SHBG con la
siguiente fórmula: testosterona total x 3,47 / SHBG) x 100. Este método tiene buena
confiabilidad en individuos con niveles normales de albúmina. Si los niveles de testosterona
con < 200 ng/dl deberá evaluarse la función tiroidea, prolactina y andrógenos adrenales (17-
hidroxiprogesterona) así como considerar la evaluación del cortisol según hallazgos de
sospecha clínica.
Niveles superiores a 200 ng/dl de testosterona es sospechoso de origen tumoral ovárico o
adrenal. Con niveles de DHEAS superiores en más del doble del valor normal 700 lg/dl (20
nmol/l), se deberá descartar un tumor suprarrenal o síndrome de Cushing.
La ecografía pélvica o una RMN es útil en mujeres con niveles elevados de andrógenos. El
volumen ovárico > 4.0 cm3 es considerado aumentado en la posmenopausia, y la
presencia de asimetría ovárica sugeriría la presencia de un tumor de ovario.
La RMN puede ser más sensible y específica que la ecografía en la identificación de
tumores de ovario con un valor predictivo positivo del 78% y un valor predictivo negativo del
100%. Aunque los tumores suprarrenales son menos comunes que los ováricos, por lo
general son de gran tamaño y se pueden identificar fácilmente con TC o RMN.
Tratamiento
La cirugía sigue siendo el principal tratamiento curativo, sobre todo en tumores secretores
de andrógenos suprarrenales, asociado o no a terapia adyuvante. Se pueden usar
agonistas de GnRH en pacientes con hiperandrogenismo ovárico sin evidencia de tumores
en imágenes y/o que no son aptos para la cirugía.
El HA relacionado con la hipertecosis ovárica puede ser tratado con ooforectomía bilateral o
análogos de GnRH, logrando mejoría de síntomas y anomalías metabólicas.
Conclusión
El diagnóstico de una causa de HA en la posmenopáusicas no siempre es fácil, por lo tanto,
la combinación del juicio clínico, una adecuada evaluación de pruebas de laboratorio e
imágenes diagnósticas deben ser empleados.
|
|
Ojo seco y calidad de vida en mujeres peri y postmenopáusicas
Dry eye disease symptoms and quality of life in perimenopausal and postmenopausal women
P.Garcia-Alfaro, S. Garcia, I. Rodriguez & C. Vergés CLIMACTERIC 2021, VOL. 24, NO. 3, 261–266
Https: //doi.org/10.1080/13697137.2020.1849087
Introducción
El ojo seco es una enfermedad multifactorial de la superficie ocular, caracterizado por pérdida de la homeostasis de la película lagrimal, acompañada por síntomas oculares acompañados de inflamación y daño de dicha superficie. Es una patología muy frecuente en la población en general, que se caracteriza por disconfort, visión borrosa, irritación, ojos rojos y fotofobia.
Con la aparición de los síntomas, ocurren limitaciones en la actividad diaria que impactan negativamente en la calidad de vida.
La prevalencia de ojo seco aumenta con la edad en ambos sexos pero la incidencia es mayor en mujeres, fundamentalmente postmenopáusicas. La anamnesis y diferentes cuestionarios son de utilidad para el diagnóstico de ojo seco.
Las glándulas de Meibomio son glándulas sebáceas de gran tamaño situadas en las placas tarsales de los párpados. Sintetizan y secretan activamente lípidos y proteínas que se distribuyen en los bordes superior e inferior del párpado. Los lípidos glandulares se esparcen en la película lagrimal, fomentando su estabilidad y evitando su evaporación. Su función está regulada por andrógenos, estrógenos, progestágenos, ácido retinoico, factores de crecimiento y, posiblemente, por neurotransmisores.
El test de BUT o tiempo de ruptura lagrimal, es el más empleado. Estudia la estabilidad de la película lagrimal, el grado de evaporación de la misma y la calidad de la lágrima.
Las tinciones de fluoresceína y lisamina examinan el daño de la superficie ocular; el test de Schirmer evalúa la producción de lágrimas. La glándula de Meibomio puede ser examinada a través de tests que estudian el volumen y la calidad de la lágrima, la facilidad de secreción y el volumen de los lípidos en la secreción estudiada.
Material y método
Este fue un estudio observacional, diseñado para evaluar la presencia de síntomas de ojo seco y el impacto de esta condición en la calidad de vida. Se realizó en un grupo de mujeres, que concurren a un centro de Ginecología. Completaron el estudio 1947 mujeres entre 45 y 79 años de edad. Se empleó el cuestionario OSDI ( Ocular Surface Disease Index) instrumento validado para cuantificar la severidad de los síntomas y discriminar a los sujetos asintomáticos de los sintomáticos. Cada ítem del OSDI se divide en un score de 0-4 en escala ascendente de los síntomas. El score se mide de 0-100. En base a estos resultados se identificaron 4 grupos ( ojo normal, sequedad leve, moderada y severa) y se empleó el STRAW para agrupar a las mujeres en función de su etapa reproductiva.
También se emplearon escalas de calidad de vida, divididos en 12 items distintos.
Resultados
Las participantes tenían un promedio de edad de 54.18 ± 6.84 años.
El 82,6% de las mujeres presentaban sensibilidad a la luz, 67.1% sensación de arenilla, 73.5% dolor o irritación, 68.8% visión borrosa y 63.7% visión deficiente.En la subescala de función visual se encontró que el 66.2% de las mujeres tenían limitaciones para leer, 52.5% para conducir en la noche, 63.7% para trabajar en la computadora y 53.4% para ver televisión.
De acuerdo al status menopáusico, se encontró que el score total del OSDI era significativamente mayor (p < 0.001) en el grupo de mujeres postmenopáusicas, tanto en la sintomatología como en la función visual. La prevalencia total de síntomas de ojo seco fue de 79% con una prevalencia de 76.4% en perimenopausia y 80.5% en mujeres en postmenopausia (p 0.029).
La disminución en la secreción de estrógenos y andrógenos ( especialmente DHEA) afectan la producción lagrimal y modificaciones en la secreción de la glándula de Meibomio, alterando la calidad de vida de las mujeres y con riesgo potencial de desarrollar patología corneal y conjuntival.
Referencias
- Garcia-Alfaro P, Bergamaschi L, Marcos C, Garcia S, Rodriguez I. Prevalence of ocular surface disease symptoms in peri- and post menopausal women. Menopause 2020;27:993–8
- Baudouin C, Messmer EM, Aragona P, et al. Revisiting the vicious circle of dry eye disease: a focus on the pathophysiology of Meibomian gland dysfunction. Br J Ophthalmol 2016;100:300–6
- Simpson TL, Situ O, Jones LW, et al. Dry eye symptoms assessed by four questionnaires. Optom Vis Sci 2008;85:692–9
- Vehof J, Kozareva D, Hysi PG, Hammond CJ. Prevalence and risk factors of dry eye disease in a British female cohort. Br J Ophthalmol 2014;98:1712–17
Prevalencia, características físicas y riesgo de caídas en adultos
mayores con y sin posible sarcopenia
Prevalence, physical characteristics, and fall risk in older adults with and without possible sarcopenia
Seung Kil Lim, Sunga Kong.
Aging Clinical and Experimental Research (2022) 34:1365–1371.
https://doi.org/10.1007/s40520-022-02078-z
La definición de sarcopenia se modificó en 2012, cuando se agregó la función muscular
disminuida. La fuerza muscular disminuye más rápido que la masa muscular a medida que
las personas envejecen, y tiene consecuencias negativas para la salud, incluida la
discapacidad, caídas, disminución de la calidad de vida e incluso la muerte.
Una disminución en la fuerza y la masa muscular inevitablemente afectará la capacidad de
los adultos mayores para realizar actividades cotidianas. El diagnóstico se realiza con una
prueba muy económica, llamada prueba de agarre o prensión.
Recientemente, el consenso del Asian Working Group for Sarcopenia (AWGS) de 2019, al
igual que European Working Group on Sarcopenia in Older People (EWGSOP),
recategorizó en: posible sarcopenia, sarcopenia y sarcopenia severa según la fuerza de
prensión.
Participaron 431 personas asiáticas (123 hombres y 308 mujeres) entre 65 y 97 años.
Dividieron a los participantes en dos grupos: normal y posible sarcopenia (fuerza de
prensión: <28 kg en hombres y <18 kg en mujeres). En este estudio, la fuerza de prensión
se midió utilizando un dinamómetro de fuerza de agarre digital.
Evaluaron características físicas (edad, peso, masa muscular, masa magra, altura y
porcentaje de grasa muscular), aptitud física y riesgo de caídas.
La posible prevalencia de sarcopenia fue del 23,7%. Se observó en adultos mayores con
menor peso, índice de masa corporal (IMC), masa muscular esquelética y masa magra
(P<0,05) que los del grupo normal. Las mujeres mayores con posible sarcopenia tenían un
riesgo de caídas entre 2,5-3,3 veces mayor que las mujeres del grupo normal. Sin embargo,
no hubo diferencias significativas en el riesgo de caídas entre los hombres mayores.
Este estudio tiene muchas limitaciones. Explica la asociación entre la posible sarcopenia y
el riesgo de caídas en relación con la disminución de la aptitud física. Sin embargo, no se
consideraron otros factores como: la vista, fármacos (anticolinérgicos, antihipertensivos),
comorbilidades como hipertensión, deterioro cognitivo y calzado.
Efectos del ejercicio sobre los síntomas vasomotores en mujeres menopáusicas: una
revisión sistemática y metanálisis
T. Liu, S. Chen, G. I. Mielke, A. L. McCarthy & T. G. Bailey (2022): Effects of exercise on vasomotor symptoms in menopausal women:
a systematic review and meta-analysis, Climacteric, DOI: 10.1080/13697137.2022.2097865
La menopausia se caracteriza por la pérdida de la función ovárica y el declive de las
hormonas sexuales (estrógenos y progesterona), ocurre naturalmente en mujeres de
mediana edad entre 45 a 55 años. Los síntomas vasomotores (SVM) (sofocos y
sudoraciones nocturnas) son los más frecuentes en esta etapa, presentándose hasta en un
85% de las mujeres durante el climaterio. Los SVM están descritos como episodios súbitos
de calor intenso asociado con sudoración profusa, enrojecimiento facial y escalofríos de una
duración de varios minutos a horas. La intensidad y frecuencia varía entre las mujeres, pero
es reconocido el impacto en su calidad de vida, además de estar asociado con mayor riesgo
cardiovascular, alteraciones del sueño, síntomas depresivos e interferencia con las
relaciones familiares, sociales y las actividades diarias.
La terapia hormonal de la menopausia (THM) es el tratamiento más efectivo y de primera
línea para el manejo de los síntomas climatéricos, logrando una reducción en la frecuencia
de los SVM en un 50 a 72% y una reducción en la severidad en un 87%. Sin embargo, en
algunas mujeres la THM está contraindicada, como es el caso de antecedentes personales
de cáncer hormonodependiente, tromboembolismo venoso o arterial, mientras que otras
mujeres eligen opciones no hormonales para el tratamiento de sus síntomas climatéricos.
El ejercicio es una alternativa para el manejo de los SVM, sin embargo los estudios hasta el
2014 informaron que la evidencia era insuficiente para determinar su eficacia. Los datos
más recientes indican que el ejercicio aeróbico, de resistencia y el yoga, tienen un efecto
positivo o limitado para reducir los síntomas de la menopausia. Está revisión busca evaluar
el efecto del ejercicio sobre la frecuencia y la gravedad de los SVM en mujeres
menopáusicas.
Se incluyeron 21 estudios controlados aleatorizados (ECA) con 2884 participantes,
encontrando:
– En 6 ECA no se observaron cambios significativos en la frecuencia de los SVM
(DME = 0,14, IC del 95 %: 0,03 a 0,31, p = 0,12, alto nivel de evidencia).
– En 10 ECA con gran alta heterogeneidad (I2 = 72 %) se encontró un efecto
significativo del ejercicio sobre la severidad de los SVM comparado con el grupo
control sin tratamiento (DME = 0,25, IC del 95 %: 0,04 a 0,47, p = 0,02, muy bajo
nivel de evidencia).
– En 3 ECA se encontró una mejoría significativas en el índice de severidad de los
SVM (severidad multiplicada por la frecuencia total), después del ejercicio en
comparación con el control sin tratamiento (DME = 0,67, IC del 95 %: 0,17 a 1,17, p
= 0,008, bajo nivel de evidencia)
– En 3 ECA se comparó el efecto del ejercicio anaeróbico y el yoga sobre la
severidad de los SVM. No reportaron diferencias significativas (DME = 0,15, IC del
95 %: 0,06 a 0,35, p = 0,15, moderado nivel de evidencia)
– En 1 ECA de 2 ramas se comparó los efectos del ejercicio aeróbico comparado
con el estiramiento sobre la severidad de SVM con un seguimiento de 12 meses.
Se encontró que el ejercicio aeróbico mostró un aumento significativo en la
severidad de los SVM en comparación con el control (p = 0,02)
– Entre los ECA que evaluaron el efecto en la severidad de los SVM, del ejercicio
comparado con grupos control (usuarios de leche de soja, terapia cognitiva
conductual, educación, nutrición y acupuntura), solo se encontraron mejoras
significativas en la severidad de los SVM en el grupo de ejercicio comparado con
con la acupuntura.
En análisis secundarios se observaron diferencias significativas (p = 0.04) para el tipo de
ejercicio en la frecuencia de los SVM comparados con el grupo de control sin tratamiento.
Específicamente, el entrenamiento con ejercicios de resistencia mejoró significativamente la
frecuencia de los SVM (DME = 0,84, IC del 95 %: 0,30 a 1,38, p=0,002), aunque en un solo
estudio.
Conclusiones:
En esta revisión se observaron efectos positivos del ejercicio en la severidad de los SVM
aunque el nivel de evidencia es muy bajo. No se encontraron efectos significativos del
entrenamiento físico sobre la frecuencia de los SVM con nivel de evidencia alta. Sin
embargo, el cumplimiento del ejercicio y los principios de prescripción fue heterogéneo. Por
otro lado, el entrenamiento de fuerza mejoró significativamente la frecuencia de los SVM,
aunque en un solo estudio. Sin embargo, la eficacia según el tipo e intensidad de ejercicio
sobre los SVM en mujeres menopáusicas, aún necesita más estudios.
La eficacia actual del ejercicio para aliviar los síntomas de los SVM podría ser baja, sin
embargo, el ejercicio es seguro y tiene grandes beneficios para la salud, por tanto debe
recomendarse. El incumplimiento de los participantes puede influir en los hallazgos sobre el
efecto del ejercicio en los SVM. También es importante comprender qué tipo de ejercicio
(aeróbico, resistencia, yoga, estiramiento o una combinación) y qué características
(frecuencia, intensidad y tiempo) son óptimos para el manejo potencial de SVM.
Teniendo en cuenta las limitaciones metodológicas de los estudios hasta la fecha, es
fundamental realizar más ECA con un diseño de estudio riguroso.
Aclaración:
– DME o sus siglas en inglés SMD: diferencia de medias estandarizada, corresponde a la
diferencia entre los promedios de los grupos comparados dividida por la desviación estándar
promedio del estudio.
– I2: porcentaje de variabilidad
|
|
|
|

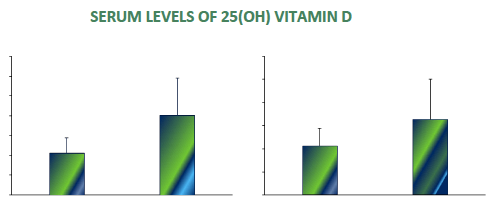
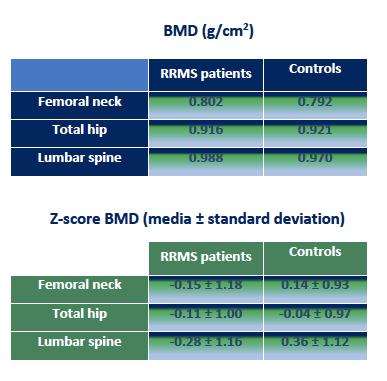 CONCLUSIONS
CONCLUSIONS